| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《原电池原理》考点巩固(2019年最新版)(十)
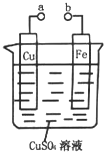 参考答案:A.a和b不连接时,发生Fe+Cu2+=Cu+Fe2+置换反应,则铁片上会有金属铜析出,故A正确; 本题解析: 本题难度:简单 2、选择题 锂~碘电池可用来为心脏起搏器提供能源,其电池反应可表示为:2Li + I2 →2LiI。下列有关说法错误的是 参考答案:D 本题解析:只有碘单质遇淀粉溶液变蓝。 本题难度:简单 3、填空题 (1)依据氧化还原反应:2Ag+(aq)?+?Cu(s)?==?Cu2+ (aq)?+?2Ag(s)设计的原电池如图所示。 参考答案:(1)①铜?;AgNO3溶液、 本题解析: 本题难度:一般 4、选择题 将氢气(H2)、甲烷(CH4)、乙醇(C2H5OH)等物质在氯气(O2)中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右).产物污染也少。人们已将它用于航天飞行器上。下图为氢氧燃料电池反应的完整过程。关于上述氢氧燃料电池的说法不正确的是 参考答案:B 本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。由于是酸性溶液,所以正极反应式为O2+4e-+4H+==2H2O,所以选项B不正确,其余选项都是正确的,答案选B。 本题难度:一般 5、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应为( ) |
参考答案:C
本题解析:钢铁发生吸氧腐蚀时,正极上发生的电极反应是2H2O+O2+4e—→4OH— ,B项是负极的电极反应,故答案选C。
考点:原电池
点评:考查原电池原理,属于基础题,解题的关键是要区分正负极发生的电极反应。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质的分离.. | |