1、选择题 下列反应的离子方程式正确的是
A.Fe203溶于过量的氢碘酸中:Fe203+6H+=2Fe3++3H2O
B.向?NaAl02溶液中通入过量CO2:AlO2-+C02+2H2O=Al(OH)3↓+HCO3-
C.向漂白粉溶液中通入S02气体:Ca2++2ClO-+S02+H2O=CaSO3↓+2HCl0
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H20
参考答案:BD
本题解析:分析:A、氢碘酸具有还原性可以被三价铁氧化为碘单质;
B、偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠;
C、次氯酸具有强氧化性氧化亚硫酸钙为硫酸钙;
D、硝酸亚铁具有还原性在酸性溶液中被稀硝酸氧化为铁离子.
解答:A、氢碘酸具有还原性可以被三价铁氧化为碘单质,反应的离子方程式为Fe203++2I-+6H+=2Fe2++3H2O+I2,故A错误;
B、偏铝酸钠溶液中通入过量二氧化碳生成氢氧化铝沉淀和碳酸氢钠,AlO2-+C02+2H2O=Al(OH)3↓+HCO3-,故B正确;
C、次氯酸具有强氧化性氧化亚硫酸钙为硫酸钙,Ca2++2ClO-+S02+H2O=CaSO4↓+2Cl-+2H+,故C错误;
D、硝酸亚铁具有还原性在酸性溶液中被稀硝酸氧化为铁离子,3Fe2++4H++NO3-=3Fe3++NO↑+2H20,故D正确;
故选BD.
点评:本题考查了离子方程式的书写方法和注意问题,掌握物质性质是解题关键,题目难度中等.
本题难度:简单
2、选择题 下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,可以使有色布条褪色
B.Cl,为不同的核素,有不同的化学性质
C.实验室制备HCl可用排饱和食盐水集气法收集
D.25℃时,1克氢气所含质子数为NA个(NA表示阿伏加德罗常数)
参考答案:D
本题解析:分析:A.氯气不能使有色布条褪色,HClO能有色布条褪色;
B.同位素具有相似的化学性质;
C.HCl极易溶于水;
D.1g氢气的物质的量为0.5mol,1个分子中含有2个质子,以此来解答.
解答:A.Cl2具有很强的氧化性,但不能使有色布条褪色,氯气与水反应生成的HClO能有色布条褪色,故A错误;
B.质子数均为17,但中子数不同,二者为同位素,其化学性质相似,故B错误;
C.HCl极易溶于水,不能用排水法(或排食盐水)收集,一般利用向上排空气收集,故C错误;
D.1g氢气的物质的量为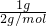 =0.5mol,1个分子中含有2个质子,则1克氢气所含质子数为0.5mol×2×NAmol-1=NA个,故D正确;
=0.5mol,1个分子中含有2个质子,则1克氢气所含质子数为0.5mol×2×NAmol-1=NA个,故D正确;
故选D.
点评:本题考查氯气的性质,明确氯气、HClO、HCl的性质及物质的量的计算即可解答,题目难度不大.
本题难度:困难
3、选择题 将绿豆大小的方形金属钠投入足量且含酚酞的水中,根据相应现象不能得出的结论是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:钠与水反应放出的热能使本身熔化成闪亮的小球,说明熔点低,浮在水面,说明密度比水小,加入酚酞的液体变红,说明生成了碱性物质,钠和水反应生成的气体使小球四处游动.
解答:A.钠和水反应变成小球,说明钠的熔点低,不能说明反应速率,故A错误;
B.钠浮在水面上,说明钠的密度小于水,故B正确;
C.酚酞遇碱变红色,酚酞溶液变成红色说明有氢氧化钠生成,故C正确;
D.钠球游动说明钠和水反应生成气体而使钠受力不均,故D正确;
故选A.
点评:本题考查钠的化学性质,题目难度不大,根据反应的实验现象推断可能具有的性质.
本题难度:一般
4、选择题 下列元素属于卤族元素的是
A.F
B.P
C.He
D.Li
参考答案:A
本题解析:卤族元素的最外层电子数都是7个,P的最外层电子数是5,He是2,Li是1,F是7,即选项A正确。答案选A。
本题难度:简单
5、选择题 下列物质既能与稀硫酸又能与烧碱溶液反应的是
A.NH4Cl
B.NaHCO3
C.FeS
D.NaHSO4
参考答案:B
本题解析:A.NH4Cl只与烧碱溶液反应
B.NaHCO3既能与稀硫酸又能与烧碱溶液反应
C.FeS 既不能与稀硫酸又不能与烧碱溶液反应
D.NaHSO4只与烧碱溶液反应
本题难度:困难