1、实验题 某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:

(1)如何检验如图所示装置的气密性:?。
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行??(填“可行”或“不可行”),原因是?。
(3)实验Ⅲ烧瓶中发生反应的化学方程式是?,打开开关K,产生的气体经验纯后点燃,现象是?。
(4)实验Ⅱ中量气管中的液体最好是____(填字母编号,下同)
a.浓NaOH溶液? b.氨水? c.煤油? d.饱和氯化铵溶液
该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有?

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②?,③视线与凹液面最低处相平。
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
编号
| 镁铝合金质量
| 量气管第一次读数
| 量气管第二次读数
|
①
| 1.0g
| 10.0mL
| 346.3mL
|
②
| 1.0g
| 10.0mL
| 335.0mL
|
③
| 1.0g
| 10.0mL
| 345.7mL
|
根据上述数据,可计算出镁铝合金中铝的质量分数为__??。
参考答案:(1)关闭分液漏斗的旋塞和开关K,向量气管中注入水使量气管内的水面高于左边容器内的水面,静置,若水面不发生变化,则气密性良好。(2分)
(2)不可行(1分);NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准(1分)
(3) CaC2+2H2O→Ca(OH)2+ C2H2↑(1分), 火焰明亮并伴有浓烈的黑烟(1分)
(4)c(1分)ACDF (2分,答对2~3个得1分,答对4个得2分,有错误答案即得0分)
(5)使量气管与干燥管两端液面相平(1分)
(6)27.0%(2分)
本题解析:略
本题难度:一般
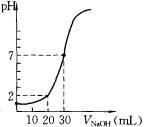
2、实验题 (14分)用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸,滴定结果如图所示。回答下列问题:
(1)有关滴定的操作可分解为如下几步,并补充完整。①用NaOH溶液润洗滴定管。②取NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL。③?④调节液面至“0”或“0”刻度以下,记下读数。⑤移取10.00 mL盐酸注入锥形瓶中,加入酚酞。⑥把锥形瓶放在滴定管的下面,用氢氧化钠溶液滴定并记下读数。
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,则会使氢氧化钠浓度的测定结果?(填“偏高”“偏低”或“不变”)。
(3)如用酚酞作指示剂,则滴定终点的实验现象是?。
(4)c(HCl)=??mol·L-1
(5)c(NaOH) =??mol·L-1
(6)右图表示50 mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)?。
A.是a mL
B.是(50-a)mL
C.一定大于a mL
D.一定大于(50-a)mL