1、选择题 现有某氯化钠(Na37Cl)6克,其中含钠元素的质量为
A.2克
B.2.3克
C.3克
D.都不对
参考答案:B
本题解析:试题分析:6g氯化钠中氯氯原子的物质的量=6g/60g/mol=0.1 mol, 0.1 mol的氯化钠中含有钠元素的质量为:0.1mol×23g/mol=2.3g。
考点:相对原子质量及其计算
本题难度:困难
2、选择题 钠和铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是( )
A.碳酸铯的化学式为Cs2CO3
B.氢氧化铯是一种强碱
C.以电解熔融的CsCl制取铯
D.Cs2CO3加热易分解出CO2、Cs2O
参考答案:A.钠和铯都是碱金属元素,Cs的离子为+1价,碳酸铯的化学式为Cs2CO3,故A正确;
B.金属性Cs>Na,故碱性比氢氧化钠强,氢氧化铯是一种强碱,故B正确;
C.Cs的金属性很强,可以用电解熔融的CsCl制备Cs,故C正确;
D.碳酸铯与碳酸钠性质类似,加热不易分解出CO2、Cs2O,故D错误,
故选D.
本题解析:
本题难度:一般
3、选择题 短周期元素A和B可形成AB3型化合物。若B原子序数为m,则A的原子序数为下面算式中的
[? ]
①m+6 ②m+4 ③m-4 ④m-2 ⑤m+8 ⑥m+14 ⑦m-12
A.②③⑥
B.①②③④
C.①②⑥⑦
D.①②③④⑤⑥⑦
参考答案:D
本题解析:
本题难度:一般
4、简答题 下表是元素周期表的一部分.
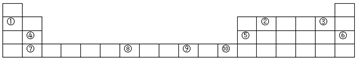
(3)②元素位于第______周期第______族,最高正价为______,最低负价为______.④元素位于第______周期第______族,最高正价为______.
参考答案:由元素在周期表中的位置可知,元素②处于第二周期第ⅣA族,该元素最高正化合价=主族族序数=最外层电子数=4,最低负化合价=最外层电子数-8=4-8=-4;
元素④处于第三周期第ⅡA族,该元素最高正化合价=主族族序数=最外层电子数=2;
故答案为:二,Ⅳ,+4,-4;三、Ⅱ,+2.
本题解析:
本题难度:一般
5、选择题 下表是元素周期表的一部分,有关说法正确的是( )
期
周
族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA
2
a
b
3
d
e
f
g
h
i
|
①a、b、e、f四种元素的元素的原子半径:e>f>b>a
②h、i两种元素阴离子的还原性:h>i
③a、g两种元素氢化物的稳定性:a>g
④d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强
⑤八种元素中d元素的单质还原性最强,i元素的单质氧化性最强.
A.①③④
B.②③⑤
C.②④⑤
D.①③⑤
参考答案:根据各元素在周期表中的位置,可知a是C,b是N,d是Na,e是Mg,f是Al,g是Si,h是S,i是Cl,
①同周期从左到右原子半径逐渐减小,所以原子半径:C>N,Na>Mg,电子层越多,半径越大,所以原子半径Na>Mg>C>N,故①错误;
②原子的得电子能力越强,单质的氧化性越强,离子的还原性越弱,得电子能力Cl>S,氧化性Cl>S,还原性Cl-<S2-,故②正确;
③原子的得电子能力越强,元素氢化物的稳定性越强,得电子能力C>Si,元素氢化物的稳定性CH4>SiH4,故③正确;
④原子的失电子能力Na>Mg>Al,元素最高价氧化物对应的水化物的碱性NaOH>Mg(OH)2>Al(OH)3,故④错误;
⑤原子的得电子能力越强,单质的氧化性越强,还原性越弱,原子的失电子能力越强,单质的还原性越强,氧化性越弱,失电子能力最强的是Na,还原性最强,得电子能力最强的是Cl,氧化性最强,故⑤正确.
故选B.
本题解析:
本题难度:简单