1、选择题 用铂电极电解下列物质的水溶液,工作一段时间后溶液pH变小的是
[? ]
A.稀硫酸
B.Na2SO4
C.AgNO3
D.KI
参考答案:AC
本题解析:
本题难度:一般
2、填空题 如图甲、乙是电化学实验装置。
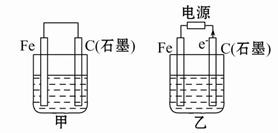
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为?;
②乙中总反应的离子方程式为?;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为:?;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为:?;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入?(填写物质的化学式)?g。
参考答案:(1)①O2+2H2O+4e-=4OH-
②2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O=10HCl+2HIO3
(2)①Fe-2e-=Fe2+
②CuO(或CuCO3)? 0.8(或1.24)
本题解析:(1)若两烧杯中均盛有饱和NaCl溶液,则:
①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-=4OH-。
②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应式为:Fe-2e-=Fe2+。②乙装置为电解池,电解反应为:2CuSO4+2H2O 2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02×
2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02× ×80 = 0.8(g),m(CuCO3)=0.02×
×80 = 0.8(g),m(CuCO3)=0.02× ×124=1.24(g)
×124=1.24(g)
本题难度:一般
3、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为?。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释)?,溶液中同时生成的沉淀还有?。
参考答案:(1)阳极反应2Fe-4e-=2Fe2+,提供还原剂Fe2+
(2)2H++2e-=H2↑ Fe(OH)3
本题解析:明确本题的电解原理:用铁作阳极,产生的亚铁离子将Cr2O72-还原为Cr3+,再转化为氢氧化铬沉淀。
本题难度:一般
4、选择题 下列说法正确的是( )
①可用电解饱和NaCl溶液的方法制取金属钠
②铝热反应一定是氧化还原反应
③以煤、石油和天然气为原料,通过化学反应可获得许多性能优异的合成高分子材料
④含硫化石燃料的大量燃烧是形成酸雨的主要原因.
A.①②③
B.②③④
C.②③
D.①②③④
参考答案:①活泼金属采用电解其熔融盐或氧化物的方法冶炼,金属钠属于活泼金属,应该采用电解熔融氯化钠的方法冶炼,故错误;
②铝热反应也属于置换反应,有单质的参加和生成,所以有电子的转移,为氧化还原反应,故正确;
③从煤、石油可以得到不饱和的小分子化合物,再通过化学反应可以获得许多性能优异的合成高分子材料,如聚乙烯等,故正确;
④二氧化硫是形成酸雨的主要成分,含硫化石燃料燃烧时能产生大量二氧化硫,所以含硫化石燃料的大量燃烧是形成酸雨的主要原因,故正确;
故选B.
本题解析:
本题难度:简单
5、选择题 下列表示对应化学反应的离子方程式正确的是
A.粗铜精炼时,与电源正极相连的是粗铜,该电极反应式只有:Cu —2e-= Cu2+
B.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O =3I2+6OH-
C.氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+
D.0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合: