1、选择题 在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是
①过量的锌与浓硫酸反应;?
②过量的氢气与少量的N2在工业生产条件下反应;
③过量的浓盐酸与碳酸钙反应;?
④过量的乙酸和少量乙醇在浓硫酸、加热条件下反应;
⑤过量二氧化锰与浓盐酸在加热条件下反应;?
⑥过量的铜与浓硫酸在加热条件下反应
A.②③④⑥
B.②④⑤⑥
C.①②④⑤
D.③④⑤⑥
参考答案:B
本题解析:锌也能和稀硫酸反应生成氢气,所以①中能完全反应;选项②和④中反应是可逆反应,反应物不能完全转化为生成物;盐酸和碳酸钙的反应能完全进行;由于二氧化锰不能氧化稀盐酸,所以选项⑤不能完全进行;同样铜和稀硫酸不反应,所以也不能完全进行,答案选B。
本题难度:困难
2、选择题 某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
A.盐酸的物质的量浓度为3.0?mol?L-1
B.能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2?g?时盐酸未反应完
D.15.7?g?混合物恰好与盐酸完全反应
参考答案:D
本题解析:分析:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;生成3.36L二氧化碳需要混合物的质量为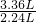 ×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
A、第二组实验中盐不足,混合物有剩余,第二组实验中发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为 =0.15mol,由方程式可知n(HCl)=n(CO2),据此计算.
=0.15mol,由方程式可知n(HCl)=n(CO2),据此计算.
B、第一组实验中混合物完全反应,盐酸过量,发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为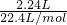 =0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知n(CO2)=n(NaHCO3)+n(KHCO3),再利用混合物质量列方程计算x、y的值,进而计算混合物中NaHCO3的质量分数.
=0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知n(CO2)=n(NaHCO3)+n(KHCO3),再利用混合物质量列方程计算x、y的值,进而计算混合物中NaHCO3的质量分数.
C、由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2?g时盐酸过量.
D、生成3.36L二氧化碳需要混合物的质量,与15.7g比较判断.
解答:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;生成3.36L二氧化碳需要混合物的质量为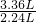 ×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
×9.2g=13.8g,所以第二组实验中盐不足,混合物有剩余.
A、第二组实验中盐不足,混合物有剩余,第二组实验中发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为 =0.15mol,由方程式可知n(HCl)=n(CO2)=0.15mol,盐酸的物质的量浓度为
=0.15mol,由方程式可知n(HCl)=n(CO2)=0.15mol,盐酸的物质的量浓度为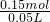 =3mol/L,故A正确;
=3mol/L,故A正确;
B、第一组实验中混合物完全反应,盐酸过量,发生反应H++HCO3-=CO2↑+H2O,生成二氧化碳的物质的量为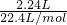 =0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知:x+y=0.1mol,混合物质量为9.2g,所以84x+100y=9.2g,联立方程解得x=0.05 mol,y=0.05 mol,能计算NaHCO3的质量分数,故B正确;
=0.1mol,设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为xmol和ymol,根据碳元素守恒可知:x+y=0.1mol,混合物质量为9.2g,所以84x+100y=9.2g,联立方程解得x=0.05 mol,y=0.05 mol,能计算NaHCO3的质量分数,故B正确;
C、由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2?g时盐酸过量,故C正确;
D、生成3.36L二氧化碳需要混合物的质量为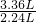 ×9.2g=13.8g<15.7克,所以混合物过量,盐酸不足,故D错误.
×9.2g=13.8g<15.7克,所以混合物过量,盐酸不足,故D错误.
故选:D.
点评:本题考查化合物的计算,题目难度较大,本题注意比较三组数据,判断反应的程度,为解答该题的关键点,也是易错点.
本题难度:困难
3、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法不正确的是
A.由反应可确定:氧化性HClO3>O2
B.由非金属性Cl>S,可推知酸性HClO3>H2SO4
C.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ Cl2↑+ HClO4 + H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
参考答案:B
本题解析:非金属性越强,最高价氧化物的水化物的酸性越强,即HClO4>H2SO4,B不正确,其余都是正确的,答案选B。
本题难度:困难
4、选择题 将一定质量的铁投入10.0ml某浓度的HNO3中恰好完全溶解,将产生的气体全部收集并与672ml(标况)O2混合恰好能完全被吸收,在铁和HNO3反应得到的溶液中滴加稀硫酸直至不再产生气体为止,又收集到无色气体224ml.则原来投入的铁的质量是
A.4.20g
B.2.80g
C.28.0g
D.42.0g
参考答案:B
本题解析:分析:在铁和HNO3反应得到的溶液中滴加稀硫酸有气体产生,说明溶液含有Fe(NO3)2,根据NO的体积计算溶液中反应消耗的Fe的物质的量,根据加硫酸后发生反应计算Fe+Fe(NO3)3=2Fe(NO3)2?中消耗Fe的物质的量,即可计算总共消耗铁的物质的量,进而计算铁的质量.
解答:在铁和HNO3反应得到的溶液中滴加稀硫酸有气体产生,说明溶液含有Fe(NO3)2,
一定质量的铁投入10.0ml某浓度的HNO3中恰好完全溶解,发生反应分别为:
①Fe+4HNO3=Fe(NO3)3+2H2O+NO↑
②Fe+2Fe(NO3)3=3Fe(NO3)2? (过量的铁跟硝酸铁反应)
③4NO+3O2+2H20=4HNO3?
由③可知672mLO2等于0.03mol,NO的物质的量为0.04mol.
反应①中消耗的Fe为0.04mol,
加硫酸后发生反应④3Fe2++4H++NO3-=3Fe3++2H2O+NO,
NO气体224ml等于0.01mol,则Fe2+有0.03mol(Fe2+是反应②所提供的),
则反应②中消耗Fe0.01mol,
Fe共有0.04+0.01=0.05mol,
质量为0.05mol×56g/mol=2.80g,
故选B.
点评:本题考查混合物的计算,题目难度中等,注意把握发生反应的可能性,从而计算消耗铁的质量.
本题难度:困难
5、选择题 能与稀盐酸或稀硫酸发生反应的黑色固体.
A.MnO2
B.石墨粉
C.FeO
D.Fe2O3
参考答案:C
本题解析:Fe2O3能与稀盐酸或稀硫酸反应,但Fe2O3为棕红色固体;MnO2、石墨粉、FeO均为黑色固体,且MnO2、石墨粉均不与稀盐酸或稀H2SO4反应,只有FeO能与稀盐酸或稀H2SO4反应.
本题难度:简单