1、填空题 (10分)Zn-Cu-H2SO4原电池的负极材料是是 ,正极反应式是 ,发生 反应(填反应类型),总反应式为___________________________________。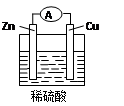
参考答案:Zn 2H++2e-=====H2↑ 还原反应 Zn+2H2SO4=====ZnSO4+2H2↑(10分)
本题解析:活泼金属做负极,相对不活泼的金属做正极,总反应Zn+2H2SO4=====ZnSO4+2H2↑
本题难度:一般
2、选择题 下图所示装置能够组成原电池,并且能产生明显电流的是( )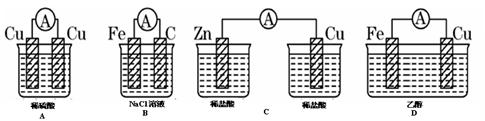
参考答案:B
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中,因此B正确,A中电极相同,C中没有构成回路,D中乙醇不是电解质,答案选B。
考点:考查原电池的构成
点评:该题属于基础性试题,难度不大。该题容易错选C,但选项C中如果添加盐桥则可以构成原电池。
本题难度:一般
3、选择题 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下:
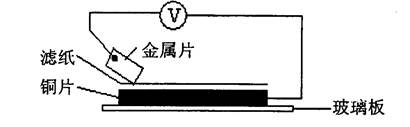
已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据记录数据判断,下列有关说法正确的是

A.在四种金属中C的还原最强
B.金属B能从硫酸铜溶液中置换出铜
C.A、D若形成原电池时,A为正极
D.A、B形成合金时,将该合金露置在空气中,A先被腐蚀
参考答案:AD
本题解析:根据电压大小可知,金属性是C、A、D、Cu、B。所以选项AD正确,答案选AD。B、不正确,B的金属性比铜弱;C、不正确,A为负极。
本题难度:一般
4、选择题 有如图装置,下列有关该装置反应开始时的叙述正确的是:
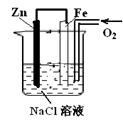
A.锌极附近滴入酚酞,溶液呈红色。
B.铁极发生的电极反应为:2H2O+O2+4e=4OH-
C.铁极发生吸氧腐蚀生成锈蚀
D.溶液中的OH-离子向铁极移动
参考答案:B
本题解析:锌比铁活泼,所以锌作负极,铁作正极。该原电池的反应相当于是吸氧腐蚀。A、锌极腐蚀氧化反应,锌失电子成为锌离子进入溶液,所以滴入酚酞,不变红色,错误;B、铁极的氧气发生还原反应,得电子成为氢氧根离子,正确;C、铁极是正极,不发生反应,被保护,错误;D、原电池中阴离子移向负极,所以OH-离子向锌极移动,错误,答案选B。
本题难度:简单
5、填空题 (l1分)物质A-E都是中学化学中常见的物质,它们可以发生如下图所示的反应,其中E是蓝色溶液。
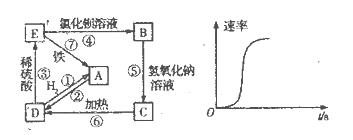
(1)在以上反应中(用序号填空),属于氧化还原反应的是____________,属于离子反应的是____________。
(2)写出反应③的离子方程式:____________________________________________。
(3)反应⑦的速率如上图,其原因可能是________________________________。
(4)从上述框图中选取电极材料和电解质溶液组成原电池,其中正极材料是________________________。负极反应为________________________________。
参考答案:(1)①②⑦;③④⑤;
(2)CuO+2H+= H2O+Cu2+;
(3)形成Fe-Cu原电池,反应速率加快,
(4)Cu,负极反应是Fe-2e-=Fe2+。
本题解析:由E是蓝色溶液判断E是硫酸铜,A是Cu,D是CuO,C是Cu(OH)2,B是CuCl2。
(1)根据以上分析判断①②⑦是氧化还原反应;在溶液中进行的反应是离子反应,所以③④⑤是离子反应;
(2)反应③是CuO与稀硫酸的反应,生成硫酸铜和水,离子方程式为CuO+2H+= H2O+Cu2+;
(3)反应⑦是铁与硫酸铜的置换反应,在硫酸铜中加入铁,置换出铜,形成Fe-Cu原电池,反应速率加快;
(4)从上述框图中选取电极材料和电解质溶液组成原电池,可选择Fe、Cu与硫酸铜或稀硫酸组成原电池,正极材料是Cu,负极反应是Fe-2e-=Fe2+。
本题难度:一般