1、选择题 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是(?)
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
2、简答题 天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) 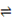 ?CO(g) + 3H2(g)? ΔH =" +206.2" kJ/mol
?CO(g) + 3H2(g)? ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g) 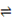 ?CO2(g) +4H2(g)? ΔH = +165.0kJ/mol
?CO2(g) +4H2(g)? ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是?。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
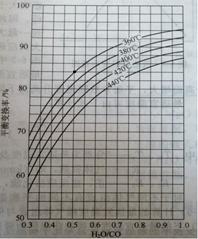
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是?。
② 汽气比相同时,CO平衡变换率与温度的关系是?。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp=?。随温度的降低,该平衡常数?(填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
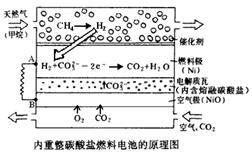
(1)外电路电子流动方向:由?流向?(填字母)。
(2)空气极发生反应的离子方程式是?。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e?转移,有??g 精铜析出。
3、选择题 人造地球卫星用到的一种高能电池--银锌蓄电池,其电池的电极反应式为:2Zn+2OH--2e-=2ZnO+H2↑ Ag2O+H2O+2e-=2Ag+2OH-据此判断氧化银是
[? ]
A.负极,并被氧化
B.正极,并被还原
C.负极,并被还原
D.正极,并被氧化
4、简答题 如图所示的电解装置中,乙池盛有20OmL饱和CuSO4溶液,丙池盛有2OOmL饱和NaCl溶液.通电一段时间后,C极增重0.64g,则:
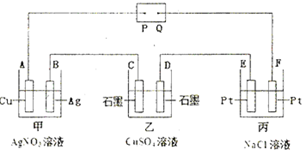
(1)P是电源的______极.
(2)甲池中,A极的质量______(填“增加”或“减少”)______g.电解一段时间,甲池溶液的pH______(填“变大”、“变小”或“不变”).
(3)D极的电极反应式为______,丙池电解反应的离子方程式为______,相同状况下,D电极与E电极产生的气体体积比为______.
(4)电解后,乙、丙电池中溶液的pH分别为乙______、丙______(设溶液体积不变,温度为室温,也不考虑溶液的水解).
(5)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度.则电解过程中转移电子的数目为______.(用NA表示)
5、选择题 一个原电池的总反应离子方程式是Zn+Cu2+═Zn2++Cu,该反应的原电池组成正确( )
| ?A | ?B | ?C | ?D
?正极
?Zn
?Ag
?Cu
?Cu
?负极
?Cu
?Cu
?Zn
?Zn
?电解质溶液
?CuCl2
?H2SO4
?CuSO4
?FeCl2
|
A.A
B.B
C.C
D.D