1、选择题 某元素R的原子的质量数为70,其核内中子数为39,它的离子有28个电子,则此元素的氧化物的化学式应为
A.RO
B.R2O3
C.RO2
D.R2O5
参考答案:B
本题解析:R的质子数为31,电子数也为31,而它的离子有28个电子,故它推动了3个电子,呈现+3价,形成的氧化物的化学式应为R2O3
本题难度:一般
2、选择题 下列各组物质的分类正确的是
①混合物:硅酸钠溶液(俗称水玻璃)、水银、水煤气、天然气
②电解质:食盐、明矾、冰醋酸、石膏
③酸性氧化物:CO2、CO、C1O2、NO2
④同位素:1H、2H2、3H
⑤同素异形体:C80、金刚石、石墨
⑥非电解质:干冰、液氯、蔗糖、无水乙醇.
A.①②③④⑤⑥
B.②④⑤⑥
C.②⑤⑥
D.②⑤
参考答案:D
本题解析:分析:①纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;
②在水溶液里或熔融状态下导电的化合物是电解质;
③能和碱反应只生成盐和水的氧化物属于酸性氧化物;
④质子数相同中子数不同的同一元素互称同位素;
⑤同一元素的不同单质互称同素异形体;
⑥非电解质是指:在水溶液里和熔融状态下都不导电的化合物;单质、混合物既不是电解质也不是非电解质.
解答:①水银是汞单质属于纯净物,故①错误;
②食盐、明矾、冰醋酸、石膏在水溶液里或熔融状态下能导电,是电解质,故②正确;
③CO、NO2既不是酸性氧化物又不是碱性氧化物,故③错误;
④同位素是原子,2H2是单质,故④错误;
⑤C80、金刚石、石墨是同一元素的不同单质,互称同素异形体,故⑤正确;
⑥液氯是单质,不是非电解质,故⑥错误.
故选D.
点评:本题考查混合物、电解质、同位素、同素异形体、非电解质等概念,题目较为简单,学习中注意对概念的理解要准确.
本题难度:简单
3、填空题 (12分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
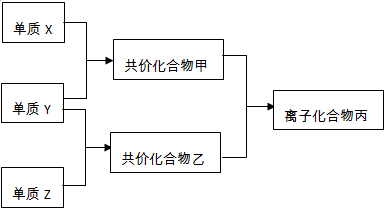
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是?。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲

①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)?。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)?
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是?。
(4)nmol丁与nmol丙在一定条件下反应,生成4nmol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是_? ___。
参考答案:(1)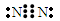 (2)
(2)
①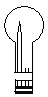
②NH4Cl与Ca(OH)2?③NH3·H2O≒NH4+ +OH-
(3) PCl5?(4)P3N3Cl6
本题解析:(1)短周期中气体单质只有五种:氢气、氮气、氧气、氟气、氯气;常见双原子单质分子中,X分子含共价键最多,可知X为N2;甲分子中含10个电子,可知甲为含有N原子的NH3,那么单质Y为氢气;乙分子含有18个电子,可知为含有H元素的HCl,即Z为氯气。
(2)考查了氨气的制取和收集及碱性
(3)P在氯气中燃烧产物有两种:PCl3和PCl5。
(4)由原子守恒知:nPCl5+nNH4Cl===(PNCl2)n +4nHCl,再由分子量为348知n=3
本题难度:一般
4、选择题 如图为周期表中短周期的一部分,A、B、C三种元素的原子核外电子数等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是()
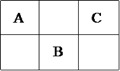
A. B为第二周期的元素
B. C为ⅤA族元素
C. 三种元素中A可以为金属元素
D. C是化学性质最活泼的非金属
参考答案:D
本题解析:根据元素的位置可知,如果设A的原子序数是x,则B就是x+9,C就是x+2。所以根据条件可知,x+x+9+x+2=2×(x+9),解得x=7,即A是N,B是S,C是 F,所以正确的答案选D。
点评:本题关键是熟练掌握元素周期表的结构,然后依据已知条件,列出关系式即可。
本题难度:一般
5、填空题 元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。
?
(1)N在元素周期表中的位置是_____;N和F处于同一行,是由于它们的_________相同。
(2)以上元素中,原子半径最小的是_____(写元素符号);最高价氧化物对应水化物中酸性最强的是__________(写化学式)。
(3)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实____________________。
(4)S和Cl中,非金属性较强的是_____(写元素符号),不能说明该结论的事实是_____。
a.氯气与铁反应生成FeCl3,硫与铁反应生成FeS
b.把Cl2通入H2S溶液中能发生置换反应
c.受热时H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体
参考答案:(1)第二周期第VA族(2分);电子层数。(2)F;HClO4。
(3)Mg,最高价氧化物对应水化物,Mg(OH)2只能与强酸反应,Al(OH)3既能与强酸反应,又能与强碱反应(合理就给分)。(4)Cl,d。
本题解析:主族元素周期数=电子层数、主族族序数=最外层电子数;同一周期中,元素的非金属性随着原子序数的增大而增强,同一主族中,元素的非金属性随着原子序数的增大而减弱;同主族自上而下,其原子半径越大,同一周期元素中,元素的原子半径随着原子序数的增大而减小;元素的非金属性越强,对应的最高价氧化物对应的水化合物酸性越强,(3)比较元素的金属性,可通过①最高价氧化物的水化物的碱性强弱;②与水或酸反应的剧烈程度;③金属之间的置换反应等角度.(4)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等化学性质的角度判断,Cl的非金属性比S的非金属性强弱与物理性质无关.。
本题难度:一般