1、选择题 下列相关表达正确的是
A.亚硫酸的电离方程式:H2SO3=2H++SO2- 3
B.中子数为18的氯原子的原子符号:18 17Cl
C.(CH3)2CHCH2CH2OH的名称:3-甲基-1-丁醇
D.HOCH2COOH缩聚产物的结构简式: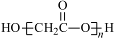
参考答案:C
本题解析:A、亚硫酸是弱酸,电离方程式用“ ”符号,错误;B、中子数是18,质子数是17,则质量数是35,所以中子数为18的氯原子的原子符号:35 17Cl,错误;C、根据醇的命名,选取含羟基的最长碳链为主链,确定羟基和取代基的位置命名,所以该醇的名称是3-甲基-1-丁醇,正确;D、羧基与羟基缩合时羧基去掉-OH,羟基去掉H原子,错误,答案选C。
”符号,错误;B、中子数是18,质子数是17,则质量数是35,所以中子数为18的氯原子的原子符号:35 17Cl,错误;C、根据醇的命名,选取含羟基的最长碳链为主链,确定羟基和取代基的位置命名,所以该醇的名称是3-甲基-1-丁醇,正确;D、羧基与羟基缩合时羧基去掉-OH,羟基去掉H原子,错误,答案选C。
本题难度:简单
2、填空题 现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
分类标准
| 金属单质
| 氧化物
| 溶液
| 胶体
| 电解质
|
属于该类的物质
|
|
|
|
|
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为__________________________________________________________。
(3)⑩在水中的电离方程式为_______________________________________________。
(4)少量的④通入⑥的溶液中反应的离子方程式为_______________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3=Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是___________,当有 5.4g Al发生反应时,转移电子的物质的量为____________。该反应的离子方程式为_____________________________
参考答案:(1)
分类标准
金属单质
氧化物
溶液
胶体
电解质
属于该类的物质
②
③④
⑧⑨
⑦
③⑤⑥⑩
(2) Ba(OH)2 + 2HNO3=Ba(NO3)2 + 2H2O(2分) (3) Al2(SO4)3 =2Al3++ 3SO42-(2分)
(4) Ba2++2OH-+CO2 =BaCO3↓+ H2O(2分)
(5) HNO3(1分) 1
本题解析:
本题难度:一般
3、选择题 下列有关化学用语表示正确的是
A.四氯化碳分子球棍模型: 
B.二氧化硅的分子式:SiO2
C.S2-离子结构示意图
D.聚丙烯的结构简式: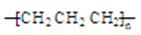
参考答案:C
本题解析:A、选项所给模型为比例模型,不是球棍模型,错误;B、SiO2是原子晶体,由原子直接构成,没有分子,所以SiO2是化学式,不是分子式,错误;B、S2?的质子数为16,核外电子数为18,结构示意图正确;D、聚丙烯的结构简式为: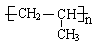 ,错误。
,错误。
本题难度:一般
4、选择题 赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S。赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2。下列说法正确的是( )
A.该反应的氧化剂只有Cu2O
B.Cu2S在反应中既是氧化剂,又是还原剂
C.Cu既是氧化产物又是还原产物
D.每生成19.2 g Cu,反应中转移1.8 mol电子
参考答案:B
本题解析:Cu2S和Cu2O中Cu的化合价均为+1价,反应后变成单质铜,Cu2S和Cu2O均为氧化剂,铜为还原产物,A、C项错误;而反应中S化合价升高,故Cu2S还作还原剂,B项正确;该反应转移6 mol电子,生成6 mol Cu,转移1.8 mol电子生成1.8 mol(115.2 g)Cu,D项错误
本题难度:一般
5、选择题 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2