1、选择题 Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,Cl2能把溴从溴化物中置换出来,其余依此类推.向NaBr、NaI的混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是( )
A.NaCl
B.NaCl、NaBr
C.NaCl、NaBr、NaI
D.NaCl、NaI
参考答案:在Br-、I-中,还原性由弱到强为Br-<I-,向含有NaBr和NaI的混合溶液中通入一定量氯气发生:2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,溴易挥发,碘易升华,
A.当氯气过量时,发生反应2NaI+Cl2=2NaCl+I2、2NaBr+Cl2=2NaCl+Br2,加热过程中,溴挥发,碘升华,所以剩余固体是氯化钠,故A不选;
B.当氯气少量时,发生反应2NaI+Cl2=2NaCl+I2,部分2NaBr+Cl2=2NaCl+Br2反应,加热过程中,碘升华,所以固体是氯化钠和溴化钠,故B不选;
C.当氯气少量时,只发生部分2NaI+Cl2=2NaCl+I2反应,加热过程中,碘升华,所以固体是氯化钠和溴化钠、碘化钠,故C不选;
D.当加入氯气,氯气先和碘离子反应,后和溴离子反应,所以固体是中不可能是氯化钠和碘化钠,故D选;
故选D.
本题解析:
本题难度:一般
2、选择题 已知X2、Y2、Z2、W2四种物质的氧化能力是W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A.2W-+Z2=2Z-+W2
B.2X-+Z2=2Z-+X2
C.2W-+Y2=2Y-+W2
D.2Z-+X2=2X-+Z2
参考答案:A.该反应中,氧化性Z2>W2,与已知不符合,所以不能发生,故A不选;
B.该反应中,氧化性Z2>X2,与已知相符,所以能发生,故B选;
C.该反应中,氧化性Y2>W2,与已知不符合,所以不能发生,故C不选;
D.该反应中,氧化性X2>Z2,与已知不符合,所以不能发生,故D不选;
故选B.
本题解析:
本题难度:一般
3、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,该反应可表示为aHClO3
参考答案:
本题解析:
本题难度:一般
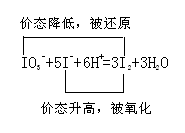
4、选择题 ?自然界存在NaIO3,可利用NaIO3与NaHSO3溶液来制取单质碘。反应分两步进行:IO3-+3HSO3-=I-+3SO42-+3H+;IO3-+5I-+6H+=3I2+3H2O。下列说法错误的是(?)
A.NaIO3是氧化剂, HSO3-是还原剂
B.生产中可得到副产物H2SO4和Na2SO4
C.I2既是氧化产物又是还原产物
D.HSO3-的还原性比I-弱
参考答案:D
本题解析:A选项正确,IO3-中I的价态+5价到产物I-,价态降低,作氧化剂。HSO3-中S的价态由+4价到产物SO42-中+6价的S,价态升高,作还原剂。B选项正确,在第一步反应中产物有SO42-生成。因环境中阳离子有H+和? Na+,所以可以得到副产物H2SO4和Na2SO4。C选项正确。D选项错误。HSO3-作为还原剂其还原性应大于还原产物I-
本题难度:一般
5、选择题 下列事实不能说明元素的金属性或非金属性相对强弱的是
序号
| 事实
| 推论
|
A
| 与冷水反应,Na比Mg剧烈
| 金属性:Na > Mg
|
B
| Ca(OH)2的碱性强于Mg(OH)2
| 金属性:Ca > Mg
|
C
| SO2与NaHCO3溶液反应生成CO2
| 非金属性:S > C
|
D
| t℃时,Br2 + H2 2HBr? K = 5.6×107 2HBr? K = 5.6×107
?I2 + H2 2HCl? K = 43 2HCl? K = 43
| 非金属性:Br > I
参考答案:C
本题解析:A、用与水反应的剧烈程度判断元素金属性的强弱,与冷水反应,Na比Mg剧烈,说明Na的金属性比Mg强,正确;B、用对应碱的碱性判断元素金属性的强弱,Ca(OH)2的碱性强于Mg(OH)2,金属性:Ca > Mg,正确;C、SO2与NaHCO3溶液反应生成CO2,说明亚硫酸的酸性比碳酸的酸性强,不能说明S与C的非金属性的强弱,错误;D、相同温度时,溴与碘和氢气化合的难易程度说明溴的非金属性比碘的非金属性强,正确,答案选C。
本题难度:一般
|