1、选择题 常温下0.1mol/L碳酸溶液中,下列离子关系式正确的是
A.c(H+)="2" c(CO32-)+c(OH-)
B.0.1= c(HCO3-)+2c(CO32-)
C.c(OH-)= c(H+) - c(HCO3-)-2 c(CO32-)
D.c(H+)>c(CO32-) > c(HCO3-)
参考答案:C
本题解析:选项A不正确,不符合电荷守恒定律,应该是c(H+)="2" c(CO32-)+c(OH-)+c(HCO3-),因此选项C正确;选项B不正确,不符合物料失衡,应该是0.1= c(HCO3-)+c(CO32-)+c(H2CO3);碳酸的第二步电离程度很小,选项D不正确,应该是c(H+) > c(HCO3-)>c(CO32-),答案选C。
本题难度:一般
2、选择题 25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2、三种溶液中,若测得其中c(NH4+)分别为a、b、c(单位为mol/L),则下列判断正确的是(?)
A.a=b=c
B. b>a>c
C.c>a>b
D.a>c>b
参考答案:C
本题解析:略
本题难度:一般
3、填空题 氯化铁水解的离子方程式为 ? ,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为 ? 。同时有红褐色沉淀生成,其原因是 ? 。
参考答案:Fe3++3H2O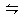 3H++Fe(OH)3;2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
3H++Fe(OH)3;2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
本题解析:氯化铁溶液中Fe3+水解的离子方程式为Fe3++3H2O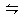 3H++Fe(OH)3;向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,是由于Fe3+水解造成的酸性与碳酸钙反应的结果,即2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
3H++Fe(OH)3;向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,是由于Fe3+水解造成的酸性与碳酸钙反应的结果,即2H++CaCO3=Ca2++CO2↑+H2O;碳酸钙消耗了H+,使Fe3+水解平衡向右不断移动,造成Fe(OH)3不断增加,至出现红褐色沉淀。
本题难度:一般
4、选择题 下列有关盐类水解的说法不正确的是()
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆反应
C.盐类水解的结果使盐溶液不一定显中性
D.Na2CO3溶液中c(Na+)是c( )的2倍
)的2倍
参考答案:D
本题解析:由于 水解,故c(Na+)>2c(
水解,故c(Na+)>2c( )。
)。
本题难度:简单
5、选择题 室温下,有关①100 mL 0.1 mol/L NaHCO3、②100mL 0.1 mol/L Na2CO3两种溶液的叙述错误的是(?)
A.两溶液中水的电离度比较:②>①
B.分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大
C.①溶液中: c(CO32-) < c(H2CO3)
D.②溶液中: c(HCO3-) < c(H2CO3)
参考答案:D
本题解析:碳酸钠生物水解程度,大于碳酸氢钠的,所以碳酸钠溶液中水的电离程度大,A正确。碳酸氢钠和氢氧化钠反应生成碳酸钠,而氢氧化钠能抑制碳酸钠的水解,所以B正确。碳酸氢钠溶液中,水解程度大于电离程度,所以选项C正确,碳酸钠的水解以第一步水解为主,所以选项D不正确,答案选D。
本题难度:一般