1、选择题 在一定温度下将1mol CO和9mol水蒸气放在密闭的容器中发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)达到平衡后,已知该反应平衡常数为K=1.0,达到新的平衡后,CO2和H2的物质的量之和为(?)
CO2(g)+H2(g)达到平衡后,已知该反应平衡常数为K=1.0,达到新的平衡后,CO2和H2的物质的量之和为(?)
A.1.2mol
B.1.5mol
C.1.8mol
D.2.5mol
参考答案:C
本题解析:考查可逆反应的有关计算,一般采用三段式。
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始量(mol)? 1? 9? 0? 0
转化量(mol)? x? x? x? x
平衡量(mol)? 1-x? 9-x? x? x
所以有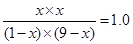
解得x=9/10
所以CO2和H2的物质的量之和为x+x=1.8mol,答案选C。
本题难度:一般
2、选择题 合成氨反应的平衡状态是指下列情况中的
A.氢气的消耗速率与氨生成的速率之比为3:2
B.体积不变时,混合气体的密度不再改变
C.氮气的生成速率与氨的生成速率之比为1:2
D.容器内物质的总质量不变
参考答案:C
本题解析:A.任意时刻氢气的消耗速率与氨生成的速率之比都是3:2。应改为氢气的消耗速率与氨的消耗速率之比为3:2时,为平衡状态。B.根据质量守恒,气体的总质量一直不变,体积又不变,所以不管有没有达到平衡状态,混合气体的密度一直都不变。D. 容器内物质的总质量一直都不变
本题难度:一般
3、填空题 在密闭容器中,将2.0molCO与10molH2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g)K=1.0
①该反应的平衡常数表达式是:______
②CO转化为CO2的转化率为:______.
参考答案:①、可逆反应CO(g)+H2O(g)催化剂
本题解析:
本题难度:一般
4、选择题 下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
参考答案:D
本题解析:A、溴水中存在下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液时,Br–与Ag+反应生成溴AgBr沉淀,平衡正向移动,Br2浓度减小,溶液颜色变浅,能用勒夏特利原理解释;B、合成氨反应为放热反应,降低温度平衡正向移动,氨的产率提高,能用勒夏特利原理解释;C、由于反应CO(g)+NO2(g)
HBr+HBrO,当加入AgNO3溶液时,Br–与Ag+反应生成溴AgBr沉淀,平衡正向移动,Br2浓度减小,溶液颜色变浅,能用勒夏特利原理解释;B、合成氨反应为放热反应,降低温度平衡正向移动,氨的产率提高,能用勒夏特利原理解释;C、由于反应CO(g)+NO2(g) CO2(g)+NO(g)为放热反应,所以升高温度,平衡逆向移动,NO2浓度增大,体系颜色变深,能用勒夏特利原理解释;D、由于反应2HI(g)
CO2(g)+NO(g)为放热反应,所以升高温度,平衡逆向移动,NO2浓度增大,体系颜色变深,能用勒夏特利原理解释;D、由于反应2HI(g) H2(g)+I2(g)是气体分子数不变的反应,缩小容器体积,平衡不移动,颜色变深是由体积变小使I2浓度增大引起的,不能用勒夏特利原理解释。
H2(g)+I2(g)是气体分子数不变的反应,缩小容器体积,平衡不移动,颜色变深是由体积变小使I2浓度增大引起的,不能用勒夏特利原理解释。
本题难度:一般
5、填空题 (10分) 容积固定的密闭容器中,发生可逆反应:M(g)+N(g)  ?2P(g)+Q(g) ΔH>0,
?2P(g)+Q(g) ΔH>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N 的浓度是?,P 的体积分数为_________。
(2)若反应温度升高,M的转化率____________ (填“增大”“减小”或“不变”,下同),平均相对分子质量____________,混合气体密度____________。
参考答案:(1)1.8 mol·L-1?30%
(2)增大?减小?不变
本题解析:略
本题难度:简单