1、选择题 甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。
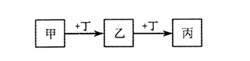
下列说法不正确的是
A.若甲是AlCl3溶液,则丁可能是NaOH溶液
B.若甲是Fe,则丁可能是Cl2
C.若丁是CO2,则甲可能为Mg
D.若丁是O2,则乙、丙的相对分子质量可能相差16
参考答案:B
本题解析:A.若甲是AlCl3溶液,向其中滴加少量的NaOH溶液时,发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl;继续滴加时,会发生反应:Al(OH)3+NaOH=NaAlO2+2H2O。正确。B.若甲是Fe,则无论Cl2量的多少,都会发生反应:2Fe+ 3Cl2 2FeCl3;后边无法发生反应。错误。C.若丁是CO2,甲为Mg,会发生反应:2Mg+ CO2
2FeCl3;后边无法发生反应。错误。C.若丁是CO2,甲为Mg,会发生反应:2Mg+ CO2 2MgO+C;CO2过量时发生反应:CO2+C
2MgO+C;CO2过量时发生反应:CO2+C 2CO;正确。D.若甲是S,发生反应:S+ O2
2CO;正确。D.若甲是S,发生反应:S+ O2 SO2,2SO2+ O2
SO2,2SO2+ O2 2SO3;SO2、SO3的相对分子质量相差16。正确。
2SO3;SO2、SO3的相对分子质量相差16。正确。
本题难度:一般
2、填空题 磷酸镁铵(NH4MgPO4)是一种重要的盐,难溶于水。化学上制备磷酸镁铵从反应原理看,是用氯化镁、磷酸氢二钠和氨水混合反应的方法。
(1)写出制备磷酸镁铵反应的离子方程式:_______________________________。
(2)在实际制备的反应中,要向混合液中加入适量的铵盐(NH+4),则加入铵盐的目的是___________________________________。
参考答案:(1)Mg2++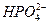 +NH3·H2O====NH4MgPO4↓+H2O
+NH3·H2O====NH4MgPO4↓+H2O
(2)抑制NH3·H2O的电离,防止生成Mg(OH)2
本题解析:第(2)题应从得到的沉淀是否纯净来考虑,因为氨水电离出的OH-能与Mg2+反应生成Mg(OH)2沉淀致使得到的磷酸镁铵不纯,加铵盐可抑制NH3·H2O电离,防止产生Mg(OH)2沉淀。
本题难度:简单
3、填空题 工业上用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的原料氧化铝。工艺流程如图
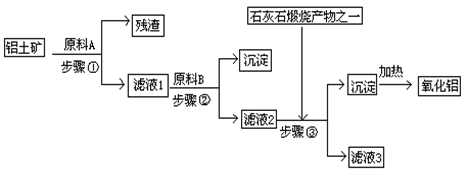
⑴原料A的名称是_____________,步骤①反应的离子方程式是_________________。
⑵滤液1中要加入稍过量原料B,原料B的化学式是________________,步骤②反应的离子方程式是:__________________________________________。
⑶步骤③的化学方程式是:_____________________________________________。
⑷如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响____________________________________________________________。
参考答案:⑴盐酸(硫酸、硝酸)? Al2O3+6H+=2Al3++3H2O? Fe2O3+6H+=2Fe3++3H2O
⑵NaOH? H++OH-=H2O? Fe3++3OH-=Fe(OH)3 ↓? Al3++4OH-=AlO2-+2H2O
⑶NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
⑷若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质
本题解析:(1)石灰石煅烧的生成物是CO2,这说明步骤③中加入的是CO2,所以滤液②中含有偏铝酸钠。因此原料B是氢氧化钠,则滤液①中氯化铝,所以试剂①是盐酸(或稀硫酸、硝酸等)。二氧化硅与酸是不反应的,所以步骤①中的离子方程式是
Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(2)滤液①中含有过量的盐酸,以及生成的氯化铝和氯化铁,所以加入过量的氢氧化钠时反应的离子方程式是H++OH-=H2O、Fe3++3OH-=Fe(OH)3 ↓、Al3++4OH-=AlO2-+2H2O。
(3)滤液③中含有过量的氢氧化钠以及生成的偏铝酸钠,所以通入过量的CO2时的化学方程式是NaOH+CO2=NaHCO3、NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
(4)若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后在生成的氢氧化铝中混有硅酸沉淀,硅酸分解生成二氧化硅,使加热制得的Al2O3混有SiO2杂质,所以不能省去步骤①。
本题难度:一般
4、选择题 拉曼光谱证实溶液中不存在 ,实际存在[Al(OH)4]-。200 mL 0.2 mol?L-1 Na[Al(OH)4]溶液与250 mL 0.2 mol?L-1 H2SO4混合,完全反应后,溶液中Al3+与 物质的量之比为(?)
A.4:5
B.2:3
C.2:5
D.1:2
参考答案:C
本题解析:2Na[Al(OH)4]+H2SO4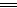 Na2SO4+2Al(OH)3↓+2H2O,
Na2SO4+2Al(OH)3↓+2H2O,
2Al(OH)3+3H2SO4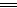 Al2(SO4)3+6H2O。
Al2(SO4)3+6H2O。
按反应方程式分两步计算:第一步,硫酸过量,剩余硫酸为0.3 mol,生成氢氧化铝0.2 mol;第二步,两种反应物恰好反应,生成硫酸铝,此时溶液中Al3+为0.2 mol,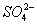 为0.5 mol。
为0.5 mol。
本题难度:简单
5、选择题 现有下列物质:①纯碱 ②小苏打 ③Al(OH)3④Al2O3⑤FeO,其中既能与盐酸反应又能与NaOH溶液反应的是(?)
A.①②③
B.②③④
C.①③④
D.①③⑤
参考答案:B
本题解析:纯碱是碳酸钠与盐酸反应生成氯化钠、水和CO2;小苏打是碳酸氢钠既能与盐酸反应生成氯化钠、水和CO2,又能与NaOH溶液反应生成碳酸钠和水;氢氧化铝和氧化铝都是两性化合物,既能与盐酸反应又能与NaOH溶液反应;氧化铁是碱性氧化物与盐酸反应生成氯化铁和水,答案选B。
本题难度:一般