1、选择题 把0.1mol铝投入到100mL3mol/L的NaOH溶液中充分反应后,再滴入1mol/L的H2SO4120mL,其结果
[? ]
A.溶液的pH<7
B.得到澄清透明溶液
C.有沉淀生成
D.先有白色沉淀生成,后逐渐溶解
参考答案:C
本题解析:
本题难度:简单
2、实验题 右图中所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
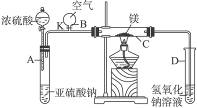
(1)C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为___________________
______________________________________________________________________________。
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯,橡胶气胆B在实验中的作用是______________________________________________________________________________。
(3)C中全部反应产物有______________、______________、______________。(填化学式)
参考答案:(1)4Mg+SiO2 2MgO+Mg2Si
2MgO+Mg2Si
(2)补充气体,维持玻璃管C中的压强与外界大气压相等,避免试管C在撤去酒精灯后,压强降低,D中液体产生倒流
(3)MgO? MgS? S
本题解析:(1)一般两种物质不能直接接触,应考虑两者之间可能发生化学反应。Mg是强还原剂,可能与SiO2反应,夺取SiO2中的氧元素。
(2)NaOH溶液是用来吸收SO2的,若根据一般的操作顺序:先撤导管,再熄灭酒精灯,这样虽不会倒流,但会污染空气。按题中操作顺序,虽不会造成大气污染,但若不维持C管里的压强,肯定会倒流,所以气胆B的作用是被充气体维持C中的压强。
(3)题中所列现象,由已熟悉CO2与Mg反应的产物可判断C中全部反应产物。冒白烟即产生了MgO,淡黄色固体肯定为S,与酸反应产生了H2S,生成物中一定有MgS。
本题难度:简单
3、选择题 镁和铝分别与等浓度、等体积的足量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( ?)
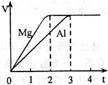
A.物质的量之比为3:2
B.质量之比为3:2
C.转移电子数之比为3:2
D.反应速率之比为2:3
参考答案:A
本题解析:
由图可知,产生氢气的体积相同,氢气的物质的量就形同,转移电子数相等,所以C错
假设都转移1摩尔电子时,镁反应1/2摩尔,铝反应1/3摩尔,物质的量之比为3:2 ,A对,质量比4:3,镁比铝活泼,反应速率之比应大于1,不是小于1.
本题难度:简单
4、填空题 明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。

请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。
参考答案:(1)KAl(SO4)2·3H2O;(2) KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
KAl(SO4)2 +3H2O;(3) Al2O3、K2SO4;0.51 g; 0.87g;SO3。
本题解析:(1)由图像分析可知:温度升至200℃,固体质量由4.74g变为2.58g,结合KAl(SO4)2·12H2O的摩尔质量(474 g/mol)和 KAl(SO4)2的摩尔质量(258g/mol)可知:该过程为0.01molKAl(SO4)2·12H2O失去全部结晶水转化为0.01mol KAl(SO4)2的过程,则温度升至64.5℃时为明矾晶体失去部分结晶水,即固体由KAl(SO4)2·12H2O变为KAl(SO4)2·xH2O,即KAl(SO4)2·xH2O的质量为3.12g,但固体的物质的量不变仍为0.01mol,KAl(SO4)2·xH2O的摩尔质量为312 g/mol,求得x=3,化学式为KAl(SO4)2·3H2O;(2)由(1)的分析结合图像知200℃时固体由KAl(SO4)2·3H2O变为KAl(SO4)2,发生反应的化学方程式KAl(SO4)2·3H2O  KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
KAl(SO4)2 +3H2O;(3)根据题意知:在770℃时充分灼烧为KAl(SO4)2的分解过程,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀,可知气体B为SO3,白色沉淀为BaSO4;向滤液D中加入BaCl2溶液也能得到白色沉淀BaSO4,滤液D中含有K2SO4,将不溶固体C置于适量的NaOH溶液中恰好反应得到澄清的溶液,C为Al2O3,即n中固体成分是的Al2O3和K2SO4;KAl(SO4)2·12H2O的物质的量为0.01mol,根据原子守恒知Al2O3的物质的量为0.005mol,质量为0.51 g,K2SO4的物质的量为0.005mol,质量为0.87g。
本题难度:一般
5、填空题  某化学兴趣小组模拟工业上从铝土矿(主要成分是
某化学兴趣小组模拟工业上从铝土矿(主要成分是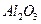 ,含
,含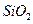 、
、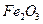 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下:
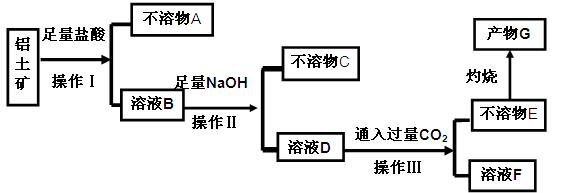

 请回答下列问题:
请回答下列问题:
 (1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
 (2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
(2)不溶物C是 (填化学式),不溶物E是 (填化学式),写出B→D反应的离子方程式 。
 (3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
(3)溶液F中含碳元素溶质的主要成份是 (填化学式),说出它的一种用途 。
参考答案:(1)过滤(1分)
(2)Fe(OH)3 (2分)?Al(OH)3?(2分)
Al3++4O H-=AlO2-+2H2O(2分)
H-=AlO2-+2H2O(2分)
(3)NaHCO3(2分)?发酵粉、食品膨松剂、治胃酸过多、制纯碱等(1分)
本题解析:略
本题难度:简单