1、选择题 将表面被氧化的铜片和铁片,同时加入足量稀盐酸中,除尽氧化膜。再经充分反应后,溶液中一定含有的金属离子是(? )
A.Fe3+和Cu2+
B.Fe2+和Cu2+
C.Fe2+
D.Fe2+和Fe3+
参考答案:C
本题解析:铜片和铁片表面的CuO和Fe2O3,加入足量的稀盐酸,先发生如下两个反应:CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O。因为Fe比Cu活泼,Fe3+的氧化性比Cu2+的强,所以再发生反应:2Fe3++Fe=3Fe2+,若Fe3+过量,则接着发生反应2Fe3++Cu=2Fe2++Cu2+,若Fe过量,则还会发生反应Fe+Cu2+=Fe2++Cu,但不论哪种情况溶液中都有Fe2+存在
本题难度:一般
2、实验题 (10分)8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
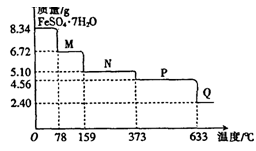
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:??。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式??
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。

①试剂X的名称是???。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ ?。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量??(填计算式)?。
参考答案:
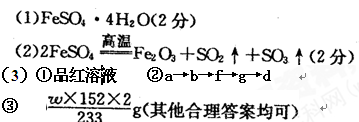
本题解析:
⑴FeS04·7H20 FeSO4·XH2O+(7-x)H2O
FeSO4·XH2O+(7-x)H2O
278? 18(7―X)
8.34? 8.34―6.72
解得X=4
FeS04·4H20
⑵2FeSO4 Fe2O3+SO2 ↑+SO3↑
Fe2O3+SO2 ↑+SO3↑
⑶①品红溶液②a→b→f→g→d
⑷2FeSO4?~? SO3?~? BaSO4
2×152? 233
m? w

本题难度:一般
3、实验题 (13分) CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
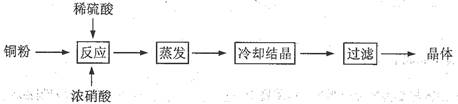
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:?、?。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160? H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为?。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用?。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、?、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是?
则a g该试样中含CuSO4·5H2O的质量为??g (用含b的代数式表示)。
[相对原子质量:H-1? O-16? S-32? Ba-137]
参考答案:(1)溶液呈蓝色,有红棕色气体生成2分
 ?(2)Cu + H2SO4 + H2O2= CuSO4 +2H2O或
?(2)Cu + H2SO4 + H2O2= CuSO4 +2H2O或
2Cu + 2H2SO4 + O2==2CuSO4 ++2H2O? 2分
(3)98%? 2分
(4)标准盐酸溶液润洗2~3次? 2分?
(5)洗涤1分?在上层清液中继续滴加加氯化钡溶液,观察有无沉淀产生2分
250b/233 g? 2分
本题解析:略
本题难度:一般
4、实验题 试简述在FeCl3溶液中加入NaOH溶液时的反应现象,并写出有关反应的化学方程式。
现象:______________________________________________;
化学方程式:______________________。
参考答案:现象:生成红褐色沉淀
化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl
本题解析:Fe3+与OH-发生反应生成红褐色的沉淀。
点评:本题考查了Fe3+与碱溶液间的反应,完成此题,可以依据从教材中所学的知识来做答。
本题难度:简单
5、填空题 (1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O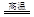 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是?,若反应中转移1mol电子,得到Cu?mol。?
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:?
?。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法?(填“正确”或“不正确”),原因是?
?。
参考答案:(1)S(或硫)(1分)? 1? (1分)?
(2)①方法一(1分),硫酸原料利用率高,对环境污染小(1分)?
②不正确? (1分)?反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同(2分)
本题解析:(1)化合价升高的元素是S,化合价降低的只有Cu 且Cu从+1价到0价,故转移1mole-时得到1molCu?
(2)①由方程式可知生成等量的CuSO4需硫酸的量方法一少,且方法一无污染。故答案为:方法一,硫酸原料利用率高,对环境污染小。
②因反应中反应物与产物不完全相同,故反应的热效应不同,消耗的能量也不同,故不正确
本题难度:一般