1、选择题 已知同温同浓度时① H2CO3比H2S电离度大,②H2S比HCO3-电离度大,则下列反应不正确的是
H2CO3比H2S电离度大,②H2S比HCO3-电离度大,则下列反应不正确的是
A.Na2CO3+H2S==NaHCO3+NaHS
B.Na2S+H2O+CO2==NaHS+NaHCO3
C.2NaHCO3+H2S==Na2S+2H2O+2CO2
D.NaHS+H2O+CO2==NaHCO3+H2S
参考答案:C
本题解析:略
本题难度:一般
2、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH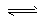 CH3COO-?+ H+,要使溶液中
CH3COO-?+ H+,要使溶液中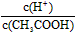 值增大,可以采取的措施是?
值增大,可以采取的措施是?
[? ]
A. 加少量烧碱溶液
B. 降低温度
C. 加少量冰醋酸
D. 加水
参考答案:D
本题解析:
本题难度:一般
3、填空题 (4分)(1)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(2)在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH
参考答案:
本题解析:
本题难度:一般
4、选择题 化合物HIn在水溶液中存在以下电离平衡,可用作酸碱指示剂:
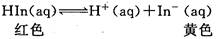
浓度为0.02mol/L的下列溶液:
①盐酸 ②石灰水 ③NaCl ④NaHS04溶液 ⑤NaHC03溶液 ⑥氯水
其中可使指示剂显红色的是(?)
①④⑥? B. ②⑤⑥? C. ①④? D. ②③⑥
参考答案:A
本题解析:①加入盐酸相当于加入氢离子,氢离子浓度增大,反应平衡向左移动。变红色②加入石灰水,石灰水与氢离子发生反应,浓度降低,反应向正反应方向移动。变黄色。③加入氯化钠,不与任何发生反应,无变化。④加入硫酸氢钠,硫酸氢根强电力,电离出氢离子,氢离子浓度增大,平衡向逆反应方向进行。变红。⑤加入碳酸氢钠,该物质为碱性,且碳酸氢根为弱电解质,消耗氢离子,反应向正反应方向进行,变黄。⑥加入氯水,与水发生反应,产生盐酸与次氯酸。电离氢离子,氢离子浓度增大。变红。
本题难度:一般
5、选择题 室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中c(CH3COO-)/[c(CH3COOH)··c(OH-)]不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:加水稀释,平衡向正向移动,导电粒子的数目增大,其浓度减少了,A错;温度不变,B项中表达式中上下同乘以c(H+),则表达式变为Ka/Kw,B正确;醋酸的电离程度越大,c(H+)不一定增大,比如加水稀释,C错;从表面上看,加入氢氧化钠溶液,刚好中和,其实醋酸是弱酸,部分电离与氢氧化钠“刚好中和”,醋酸的起始浓度远大于它电离出的c(H+),故醋酸过量,中和后显酸性,D错。答案选B。
本题难度:一般