1、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+2 Na2SO4 + 2 H2O
(1)方法一的离子方程式为 。
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L。
(3)与方法一比较,用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
参考答案:(1)2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑+ Cl2↑+ 2 H2O
(2)H2O2,2.24
(3)方法一制得的ClO2中含有Cl2
本题解析:
试题解析:(1)根据离子方程式的书写原则,易溶且易电离的电解质在书写离子方程式时写成离子形式,删去方程式两边不参加反应的离子,检查方程式两边是否满足元素守恒、电荷守恒,所以方法一的离子方程式为:2ClO3-+ 4 H+ + 2Cl-=2 ClO2↑+ Cl2↑+ 2 H2O。
(2)根据氧化还原反应理论,被氧化的物质是元素化合价升高的物质,在方法二中,化合价升高的元素是H2O2中的氧元素,所以被氧化的物质是H2O2。每生成1mol ClO2气体,则转移1mol电子,所以当有0.1mol电子转移时,则生成0.1mol ClO2气体,标准状况下的体积为2.24L。
(3)氯气用于自来水消毒时易产生对人体有害的有机氯代物,方法一中有氯气产生,所以方法二更适合制备ClO2。
考点:考查离子方程式的书写、氧化还原反应理论的运用以及化学在生活中的应用
本题难度:一般
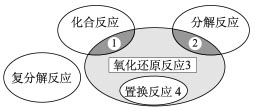
2、选择题 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是
A.2H2+O2点燃2H2O
B.CuO+CO  Cu + CO2
Cu + CO2
C.2NaHCO3 Na2CO3+H2O +CO2↑
Na2CO3+H2O +CO2↑
D.Zn +H2SO4 =ZnSO4 + H2↑
参考答案:B
本题解析:根据图片可知,区域3是氧化还原反应,但不是置换反应,也不是化合反应和分解反应。所以选项B正确。
本题难度:一般
3、选择题 下列叙述正确的是
① 7Li+中含有的中子数与电子数之比为2
参考答案:
本题解析:
本题难度:一般
4、简答题 日本核泄漏中最危险的是131I,它能引发甲状腺癌.但127I却是人体必需的.
(1)下列有关碘的描述中,正确的是______.
A.?126I、127I、128I、131I是四种相同的核素
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I.碘盐含127I为?30mg?kg-1,成人一次摄入碘盐约3kg才有预防效果.所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I?为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射
(2)碘盐(含KIO3)含碘量可用下列方法来测定:IO3-+5I?-+6H+=3I2+3H2O;?I2+2S2O32-=2I?-+S4O62-取a?g碘盐于锥形瓶中,用适量水溶解,再加入过量的KI溶液并用硫酸酸化,用b?mol?L-1?Na2S2O3溶液滴定I2,滴定终点时用去c?mL?Na2S2O3溶液,则该盐中碘的质量分数为______(用a、b、c表示).
(3)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I?-(aq)?I3-(aq)?…①
I2(aq)+2I?-(aq)?I?42-(aq)?…②
则反应②的平衡常数表达式,K=______.
I2的起始浓度均为0.1mol?L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
| KI起始浓度/mol?L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10
I3-%
88.98
88.04
85.28
82.26
79.23
I42-%
4.38
8.67
12.60
16.21
19.53
|
根据表中数据,可得出的两条结论是______、______.
参考答案:(1)A、I-126、I-127、I-128、I-131,质子数相同,中子数不同,是不同的核素,互为同位素,故A错误;
B、131I的半衰期很短,衰变很快,浓度很低,对人无影响,故B正确;
C、食盐中食盐中碘的含量很低,日用碘盐对预防碘辐射起不到有效作用,故C正确;
D、碘片中含量高,可防止131I的辐射,应按医嘱服用碘片,否则会碘中毒,故D正确.
故选:BCD;
(2)n(Na2S2O3)=bmol?L-1×0.001cL=0.001cbmol,
由方程式IO3-+5I?-+6H+=3I2+3H2O;?I2+2S2O32-=2I?-+S4O62-可知,反应的关系式为:KIO3~3I2~6S2O32-,
所以:n(KIO3)=16×n(Na2S2O3)=16cb×10-3mol,
m(I)=16cb×10-3mol×127g/mol=1276cb×10-3g,
所以ag食盐中碘的质量分数为1276cb×10-3a=127bc×10-36a,故答案为:127bc×10-36a;
(3)平衡常数指生成物浓度系数次幂的乘积与每反应物浓度系数次幂的乘积的比值,
所以反应I2(aq)+2I?-(aq)?I?42-(aq)?的平衡常数k=c(I2-4)c(I2)?c2(I-),
由表可知,条件相同时,I3-离子的物质的量分数组成始终占绝对优势;
随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加,
故答案为:c(I2-4)c(I2)?c2(I-);条件相同时,I3-离子的物质的量分数组成始终占绝对优势;随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加.
本题解析:
本题难度:一般
5、选择题 ClO2是一种消毒杀菌剂,实验室可通过下列反应制得ClO2:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法中正确的是(?)
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4被还原
D.1molKClO3发生反应,转移的电子数为2NA
参考答案:A
本题解析:B项:ClO2是还原产物,故错;C项:H2C2O4被氧化,故错;D项:1molKClO3发生反应,转移的电子数为NA,故错。故选A。
点评:本题考查氧化还原反应的特应用,要求学生具有分析和解决问题的能力,难度较不大。
本题难度:一般