1、选择题 在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)?
N2(g)+CO2(g)△H=-373.2kJ?mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时减小压强
参考答案:A.催化剂不改变平衡状态,升高温度平衡逆向移动,NO的转化率减小,故A错误;
B.催化剂不改变平衡状态,增大压强,平衡正向移动,NO的转化率增大,且反应速率加快,故B正确;
C.升高温度平衡逆向移动,NO的转化率减小,充入N2平衡逆向移动,NO的转化率减小,故C错误;
D.降低温度同时减小压强,反应速率均减小,故D错误;
故选:B.
本题解析:
本题难度:一般
2、填空题 反应:N2(g)+3H2(g) 2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
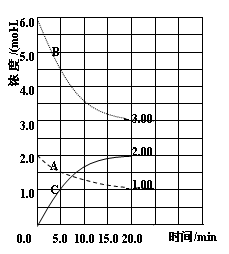
(1)图中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)下图是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可。曲线上必须标出N2、H2、NH3)。
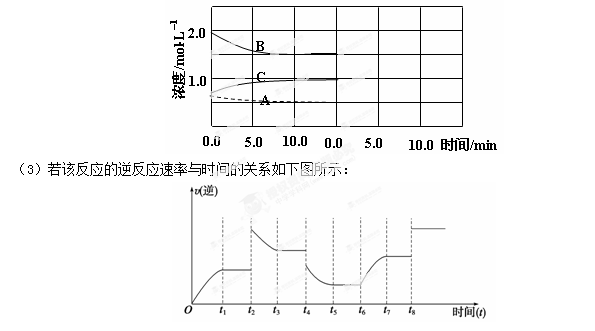
反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”……
参考答案:
本题解析:
本题难度:困难
3、选择题 某温度下,在容积固定的密闭容器中,发生可逆反应中A(g)+2B(g) 2Q(g)
2Q(g)
平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q(相当加压),则下列叙述正确的是
A.刚充入时反应速率:v(正)减小,v(逆)增大
B.达到新的平衡时:反应混合物中A.B的体积分数增加
C. 达到新的平衡时:c(A):c(B):c(Q)仍为1:1:2
D. 达到新的平衡过程中:体系压强先增大,后减小
参考答案:D
本题解析:A、刚充入时相当于增大压强,正逆反应的速率都增大,错误;B、增大压强,平衡正向移动,A、B的体积分数减小,错误;C、由于平衡发生了移动,所以再达平衡时各物质的物质的量浓度之比发生变化,不是1:1:2,错误;D、刚充入时体系的压强增大,随着反应的正向进行,是体系的压强逐渐减小,所以压强是先增大后减小,正确,答案选D。
考点:考查化学平衡移动的判断,反应速率的变化与条件改变的关系
本题难度:一般
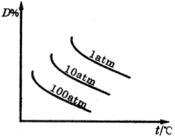
4、选择题 在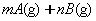

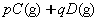 反应中,达到平衡后,的质量分数D%随温度、压强的变化曲线如下图所示正确的结论是(?)。
反应中,达到平衡后,的质量分数D%随温度、压强的变化曲线如下图所示正确的结论是(?)。
A.正反应放热,且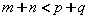
B.正反应放热,且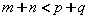
C.正反应吸热,且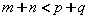
D.正反应吸热,且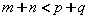
参考答案:B
本题解析:因温度越高D%越小,所以正反应为放热反应,因压强越大,D%越小,所以正反应为扩大体积反应。
本题难度:简单
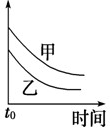
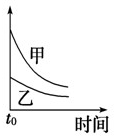
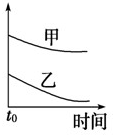
5、选择题 下列表格中的各种情况,可以用下面对应选项中的图象曲线表示的是( )
| 选项 | 反应 | 纵坐标 | 甲 | 乙
A
外形、大小相近的金属和水反应 | 反应速率
Mg
Na
B
4mL?0.01mol/L的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液各2mL反应
0.1mol/L的H2C2O4溶液
0.2mol/L的H2C2O4溶液
C
5mL?0.1mol/L?Na2S2O3溶液和5mL?0.1mol/L?H2SO4溶液反应
热水
冷水
D
5mL?4%的过氧化氢溶液分解放出O2
无MnO2粉末
加MnO2粉末
|
A.

B.
C.
D.
参考答案:A.Na比Mg活泼,反应速率快,则图象中乙应在上方,故A错误;
B.浓度大,反应速率快,则图象中乙应在上方,故B错误;
C.温度高,反应速率快,随反应的进行,正反应速率逐渐减小,甲的温度高,图中中应在上方,与图象一致,故C正确;
D.加催化剂,反应速率加快,则图中应乙在上上,故D错误;
故选C.
本题解析:
本题难度:简单