1、填空题 在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO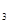 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO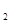 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
参考答案:(5分)(1)固体表面积(2)催化剂(3)物质的性质(4)溶液的浓度(5)温度
本题解析:可以根据影响化学反应速率的因素方面进行分析、判断,从而得出正确的结论。
(1)黄铁矿煅烧时要粉碎成细小的矿粒,可以增大反应物的接触面积,加快反应速率。
(2)熔化的氯酸钾放出气泡很慢,若加入少量Mn02时分解加速,说明化学反应速率受催化剂的影响。
(3)同浓度、同体积的盐酸中放入同样大小的碳粒和镁条,产生气体有快有慢,这说明影响化学反应速率的因素是反应物自身的性质。
(4)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同,这是由于盐酸的浓度不同引起的,反应物的浓度越大,反应速率越快。
(5)夏天的食品易霉变,冬天就不易发生该现象,这是由于夏天气温高,故食品易霉变,而冬天气温低不易发生该现象,因此温度高低对反应速率有影响,温度越高反应速率越快。
点评:该题是基础性试题的考查,难度不大。明确反应速率的含义以及影响因素是答题的关键。因此解答本题时要充分理解影响化学反应速率的因素,然后才能对问题做出正确的判断。
本题难度:一般
2、填空题 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.
(1)用此装置进行定量实验,应选用上述的实验药品是:______;
(2)应该测定的实验数据是______;
(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的):______.
参考答案:(1)该装置左边为分夜漏斗,锥形瓶,分液漏斗为加液体,锥形瓶为反应容器,右边为量气装置,且该装置不需加热,该实验的目的为探究不同浓度的硫酸对反应速率的影响,进行的是定量实验,所以需选用的实验药品为统一溶质硫酸不同浓度与较活泼的金属固体反应,故答案为:Fe、0.5mol/L硫酸、2mol/L硫酸;
(2)反应速率的表示方法为单位时间内反应物浓度的减少,或生成物浓度的增加.探究不同浓度的硫酸对反应速率的影响,所以可以测生成物气体的体积或生成气体所需的时间,故答案为:测定一定时间产生的体积(或者测定一定体积的气体所需的时间);
(3)影响反应速率的因素有:浓度、温度、气体的压强、固体的表面积大小、催化剂等.该实验假设金属颗粒是均匀的已考虑表面积,该实验未用催化剂,所以应考虑热效应,金属与酸反应为典型的放热反应,所以硫酸浓度大的,反应放出的热量大,温度相对高一点,温度高反应速率快,所以该实验为考虑温度对反应速率的影响,故答案为:温度对反应速率的影响;
本题解析:
本题难度:简单
3、选择题 为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
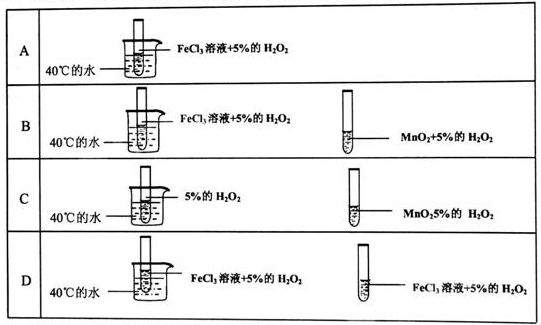
A.A
B.B
C.C
D.D
参考答案:A、没有参照物,所以无法判断,故A错误.
B、催化剂、温度都不同,所以无法判断,故B错误.
C、两个实验的影响因素不同,所以无法判断,故C错误.
D、两个实验的不同点只有温度,所以能判断温度对化学反应速率的影响,故D正确.来源:91考试网 www.91eXam.org
故选D
本题解析:
本题难度:简单
4、选择题 工业合成氨N2+3H22NH3,其正反应为放热反应,如果反应在密闭容器中进行,下列有关说法中正确的是( )
A.该反应使用铁触煤作催化剂,目的是为了增大反应速率,同时提高产率
B.升高温度可以增大正反应速率,同时减小逆反应速率
C.达到平衡时,N2、H2、NH3的浓度之比为1:3:2
D.为了提高H2的转化率,可适当提高N2的浓度
参考答案:A、使用催化剂增大反应速率,不影响化学平衡移动,物质的转化率不变,故A错误;
B、升高温度同时增大正、逆反应速率,故B错误;
C、达到平衡时,N2、H2、NH3的浓度之比不一定等于化学计量数之比,越物质的起始浓度与温度等有关,故C错误;
D、增大N2的浓度,平衡向正反应移动,H2的转化率增大,N2自身转化率降低,故D正确.
故选:D.
本题解析:
本题难度:简单
5、选择题 右图所示是可逆反应X2+3Y2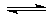 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
A.t1时,只有正向反应
B.t2时反应达到限度
C.t2-t3时,反应停止
D.t2-t3时,v(Y2)=v(Z)
