1、选择题 已知:
①25 ℃、101 kPa时,2C(s)+O2(g) 2CO(g) ΔH="-221" kJ·mol-1
2CO(g) ΔH="-221" kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) H2O(l) ΔH="-57.3" kJ·mol-1
H2O(l) ΔH="-57.3" kJ·mol-1
又已知弱电解质电离吸热。下列结论正确的是( )
A.C的燃烧热大于110.5 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量
参考答案:A
本题解析:①的反应热为-221 kJ·mol-1;稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ·mol-1;稀醋酸与稀NaOH溶液反应生成1 mol水放出的热量小于57.3 kJ。
本题难度:一般
2、选择题 常温下,将NH4NO3溶于水得无色溶液,为使该溶液中的c(NH4+)∶c(NO3-)=1∶1,可以采取的下列措施是( )
A.加入适量的HNO3,抑制NH4+水解
B.加入适量的氨水,使溶液的pH等于7
C.加入适量的NH4NO3
D.加入适量的NaOH,使溶液的pH等于7
参考答案:B
本题解析:因为NH4+部分水解使NH4NO3溶液中c(NH4+)∶c(NO3-)<1∶1,要使c(NH4+)∶c(NO3-)=1∶1,可通过抑制水解达到目的。A中增加了NO3-;B中根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(OH-),又pH=7,则c(NH4+)=c(NO3-);C增加NH4NO3的浓度,其比值依然小于1∶1,D中由电荷守恒:c(NO3-)+c(OH-)=c(H+)+c(NH4+)+c(Na+),因为pH=7,显然c(NO3-)≠c(NH4+)。
本题难度:一般
3、选择题 在25℃时, 0.1mol·L-1的HX溶液中,c (OH-)/c (H+) =1×10—6,在该条件下对0.1mol·L-1的HX溶液,下列说法中正确的是
A . HX的电离方程式为:HX=H+ + X— ?
B?此溶液的pH=1
C.该溶液中c(HX)> c (H+)> c (X-)>c (OH-) ?
D.与PH=10的NaOH溶液等体积混合溶液呈中性
参考答案:C
本题解析:c (OH-)/c (H+) =1×10—6,10-14/10-6=c(H+)2,得c (H+) =1×10—4 mol·L-1,HX为弱酸。
A .不正确,HX是弱电解质,它的电离方程式为:HX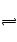 H+ + X—
H+ + X—
B?不正确,c (H+) =1×10—4 mol·L-1,此溶液的pH=4
C.正确,该溶液中c(HX)> c (H+)> c (X-)>c (OH-) ?
D.不正确,与PH=10的NaOH溶液等体积混合溶液呈酸性,酸浓度大,NaOH不足。
选C。
本题难度:一般
4、选择题 下列属于水解离子方程式且正确的是
A.HCO3-+ H2O  H3O+ + CO32-
H3O+ + CO32-
B.NH3 + H2O  NH4+ + OH-
NH4+ + OH-
C.CO32-+2H2O  H2CO3 + 2OH-
H2CO3 + 2OH-
D.Al3+ +3H2O  Al(OH)3+3H+
Al(OH)3+3H+
参考答案:D
本题解析:A:两边儿去一个水分子可看出,这属于电离方程式,不正确
B:这是一水合氨的电离方程式,不正确
C:多元弱酸根离子水解要分步进行,且以第一步为主,不正确
D:正确
答案为D
本题难度:简单
5、选择题 室温时,M(OH)2(s) M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于(?)
M2+(aq)+2OH-(aq) Ksp=a。c(M2+)=b mol·L-1时,溶液的pH等于(?)
A.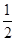 lg(
lg(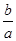 )
)
B.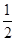 lg(
lg(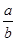 )
)
C.14+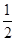 lg(
lg(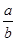 )
)
D.14+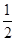 lg(
lg(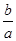 )
)
参考答案:C
本题解析:本题考查溶度积常数及溶液pH的计算,意在考查考生对溶度积常数的理解能力。根据M(OH)2的Ksp=c(M2+)·c2(OH-),则溶液中c(OH-)=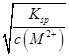 =
=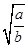 ,则pH=-lg c(H+)=-lg(10-14÷
,则pH=-lg c(H+)=-lg(10-14÷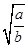 )=-(-14-
)=-(-14-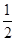 lg
lg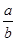 )=14+
)=14+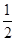 lg
lg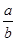 。
。
本题难度:简单