1、填空题 (8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
①硫酸溶液
| ②硫酸氢钠溶液
| ③醋酸溶液
| ④盐酸
|
HSO4-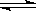 H++SO42— H++SO42—
| HSO4-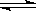 H++SO42- H++SO42-
| CH3COOH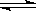 CH3COO-+H+ CH3COO-+H+
| HCl = H++Cl-
|
10℅
| 29℅
| 1.33℅
| 100℅
|
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式?
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是?(填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是?;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:?
2、选择题 下列物质能促进水的电离的是
A.小苏打
B.醋酸
C.乙醇
D.氯化钠
3、选择题 常温下,向纯水中加入氢氧化钠,使溶液的PH为10,则由氢氧化钠电离出的OH-离子浓度与水电离出的OH-离子浓度之比为
A.1010:1
B. 108:1
C.106:1
D.1:1
4、填空题 (10分)运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=?;用离子方程式表示FeCl3溶液用于净水的原因?。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。
在NaHSO4溶液中c(H+)?c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH?7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为?。(已知Ksp(BaSO4)=1.1×10-10)
(4)写出下列反应的化学方程式:
苯的硝化反应 ?。 乙醇的催化氧化反应?。
5、选择题 现有常温下的四种溶液(如下表),下列有关叙述中正确的是(?)
?
| ①
| ②
| ③
| ④
|
溶液
| 氨水
| 氢氧化钠
| 醋酸
| 盐酸
|
pH
| 11
| 11
| 3
| 3
|
A.温度下降10℃,四种溶液的pH均不变
B.分别加水稀释10倍,四种溶液的pH大小为①>②>④>③
C.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
D.等体积的③、④两种溶液分别与②反应,恰好中和时,消耗②的体积相等