1、选择题 某氯化镁溶液的密度为1.18g?cm-3,其中镁离子的质量分数为5.11%.300mL该溶液中Cl-离子的物质的量约等于( )
A.0.37mol
B.0.63mol
C.0.74mol
D.1.5mol
参考答案:氯化镁溶液的密度为1.18g?cm-3,其中镁离子的质量分数为5.11%,
则c(Mg2+)=1000×1.18×5.11%24≈2.5mol/L,
c(Cl-)=2c(Mg2+)=5.0mol/L,
所以300mL该溶液中Cl-离子的物质的量约等于0.3L×5.0mol/L=1.5mol,
故选D.
本题解析:
本题难度:简单
2、简答题 Ⅰ.如图所示是分离混合物时常用的仪器,回答下列问题:
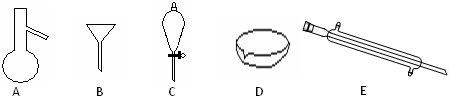
(1)写出仪器A、C、E的名称______
(2)分离以下混合物应该主要选用什么仪器?(填字母符号)
食用油和酒精:______?汽油和水:______
Ⅱ.实验室用固体烧碱配制200mL?0.5mol?L-1的NaOH溶液.
(1)需称量______?g?烧碱,应放在______中称量、溶解.
(2)完成此配制实验,除了量筒,烧杯,玻璃棒外还需要的常见的玻璃仪器有______
(3)请描述定容操作应采取的具体方法______.
参考答案:Ⅰ(1)图中A是蒸馏烧瓶、C是分液漏斗、E是冷凝管,故答案为:蒸馏烧瓶、分液漏斗、冷凝管;
(2)食用油和酒精,互溶,沸点相差较大,可以采取分馏的方法分离,需要用到的仪器为蒸馏烧瓶、冷凝管等,汽油和水为互不相溶的液体,可以利用分液方法分离,需要的仪器为分液漏斗,
故答案为:AE;C;
Ⅱ(1)没有200mL容量瓶,应选择250mL容量瓶,故需要氢氧化钠的质量为0.25L×0.5mol?L-1×40g/mol=5.0g,
氢氧化钠具有腐蚀性、易潮解,应放在烧杯内,迅速称量、溶解,
故答案为:5.0;烧杯;
(2)配制氢氧化钠溶液需要玻璃仪器有烧杯、玻璃棒、250mL容量瓶、胶头滴管等,
故答案为:250mL容量瓶、胶头滴管;
(3)定容操作为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切,
故答案为:向容量瓶内注入蒸馏水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线正好水平相切.
本题解析:
本题难度:一般
3、选择题 某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于
[? ]
A. 0.37mol
B. 0.63mol
C. 0.74mol
D. 1.5mol
参考答案:D
本题解析:
本题难度:简单
4、填空题 将24.4gNaOH固体溶于水配成100mL溶液,其密度为1.22g/mL.
(1)该溶液中NaOH的物质的量浓度为______.
(2)该溶液中NaOH的质量分数为______.
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为______,NaOH的质量分数为______,溶液的密度为______,含NaOH的质量为______,含NaOH的物质的量为______.
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______.
参考答案:22.4gNaOH的物质的量为24.4g40g/mol=0.61mol,溶液质量为100mL×1.22g/mL=122g,
(1)该溶液中NaOH的物质的量浓度为0.61mol0.1L=6.1mol/L,
故答案为:6.1mol/L;
(2)该溶液中NaOH的质量分数为24.4g122g×100%=20%,故答案为:20%;
(3)溶液是均匀的,取出10mL溶液的物质的量浓度、质量分数、密度与原溶液相等,故溶液的物质的量浓度、质量分数、密度分别为6.1mol/L、20%、1.22g/mL,
该10mL溶液中氢氧化钠的质量、物质的量为原溶液中的110,分别为2.44g、0.061mol,
故答案为:6.1mol/L;20%;1.22g/mL;2.44g;0.061mol;
(4)取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为0.061mol0.1L=0.61mol/L,
故答案为:0.61mol/L.
本题解析:
本题难度:一般
5、选择题 医院体检的血液化验单中,某患者葡萄糖为0.0079mol/L.表示该体检指标是( )
A.物质的量(n)
B.物质的量浓度(c)
C.质量分数(w)
D.摩尔质量(M)
参考答案:mol/L是物质的量浓度的单位,葡萄糖为0.0079mol/L,表示每1L血液中含有葡萄糖的物质的量是0.0079mol,
故选B.
本题解析:
本题难度:一般