1、填空题 利用图所示装置收集以下6种气体(图中烧瓶的位置不得变化)。 ①H2②Cl2 ③CH4 ④HCl ⑤NH3⑥SO2 若烧瓶是干燥的, 则由A口进气,可收集的气体有(写序号); ____? ;
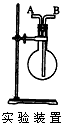
参考答案:①③⑤
本题解析:
本题难度:一般
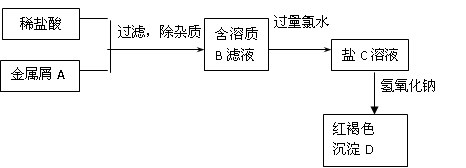
2、填空题 下图表示某种盐C的制备及其性质的实验步骤:
 ?
?
已知:盐C溶液呈黄色;沉淀D焙烧分解,生成红棕色粉末E。
(1)请写出下列物质的化学式:
A?,B?,C?,D?,
(2)写出相应反应的离子方程式
A→B:?,B→C:?,
(3)向B的溶液中滴加NaOH溶液,可观察到白色沉淀产生,该沉淀在空气中放置的现象为?,发生上述变化的化学方程式为?
参考答案:(1)? Fe?、? FeCl2 ?、? FeCl3?、? Fe(OH)3?
(2)? Fe + 2H+ = Fe2+ + H2 ↑?、? 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
(3)?白色沉淀转化为灰绿色,最后变成红褐色?
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
本题解析:红褐色沉淀D一定为Fe(OH)3,可判定金属A为铁;
铁与盐酸反应:Fe + 2H+ = Fe2+ + H2 ↑,得到FeCl2,即B溶液;
B溶液中加入大量氯水,被氧化为盐C:FeCl3:2Fe2+ + Cl2 = 2Fe3+ + 2Cl—
盐C与碱溶液反应:Fe3+ +3OH—=Fe(OH)3↓
(3)向B的溶液(FeCl2)中滴加NaOH溶液,可观察到白色沉淀产生:Fe2+ +2OH—=Fe(OH)2↓,该沉淀在空气中易被氧化,白色沉淀转化为灰绿色,最后变成红褐色:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
本题难度:简单
3、实验题 利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
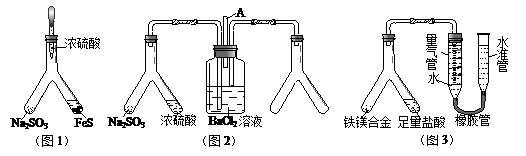
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为?,硫化亚铁处加水的目的是?。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是?和 ?,导气管A的作用是?。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是?;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为?(精确到0.01%)。
参考答案:(17分)
(1)(共4分)管壁内有淡黄色固体生成(2分)?稀释浓硫酸,防止硫化氢被氧化(2分)
(2)(共6分)浓氨水、生石灰(或碱石灰、固体NaOH,4分)?保持集气瓶内外气压平衡(1分),以便左右两边产生的气体顺利导入(1分)
(3)(共7分)①放低(或移动)水准管位置(2分 ),使水准管、量气管内液面相平(2分)?②70.00%(3分)
本题解析:(1)依题意,二氧化硫气体与硫化氢气体反应生成单质硫和水,由此推断反应现象为管壁内有淡黄色固体生成、有液滴生成;由于硫化氢能被浓硫酸氧化,则硫化亚铁出加水的目的是稀释浓硫酸,防止稀硫酸与硫化亚铁反应放出的硫化氢气体被浓硫酸氧化;(2)根据二氧化硫的性质推断,右侧Y型管的作用是制取氨气,由于无加热仪器,则选择的试剂为浓氨水液体和生石灰或碱石灰或氢氧化钠固体,产生的氨气溶于BaCl2溶液,得到碱性溶液,再通入二氧化硫气体时,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与BaCl2溶液发生复分解反应,可以得到白色BaSO3沉淀和NH4Cl溶液;导管A的作用是保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入;(3)读数时,应放低(或移动)水准管位置,使水准管中的液面高于量气管中液面相平,以免造成误差;防止倒吸;设铁镁合金含有xmolFe、ymolMg,根据m=n?M,则①56x+24y=0.080;由于Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑中的系数之比等于物质的量之比,充分反应后得到氢气的物质的量为(x+y)mol;由于初末读数相差(45.80—1.00)mL=(45.80—1.00)×10—3L,说明充分反应后得到氢气的体积为(45.80—1.00)×10—3L;由于n=V/Vm,根据氢气的物质的量相等可得:②x+y =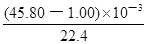 ;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为
;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为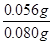 ×100%=70%。
×100%=70%。
本题难度:一般
4、选择题 实验室制取下列气体时,下列尾气吸收方法中不正确的是
A.Cl2的尾气,可用NaOH溶液吸收
B.NH3的尾气,可用H2SO4溶液吸收
C.SO2的尾气,可用酸性KMnO4溶液吸收
D.NO2的尾气,可用H2O来吸收
参考答案:D
本题解析:
答案:D
A ?Cl2+2NaOH=NaCl+NaClO+H2O
B? 2NH3+H2SO4=(NH4)2SO4
C? 5SO2+2MnO4―+2H2O=5SO42―+2Mn2++4H+
D?应用NaOH或Na2CO3等来吸收
本题难度:一般
5、选择题 下列可用浓H2SO4干燥的气体有( )
①H2?②SO2?③H2S?④Cl2?⑤NH3?⑥HCl?⑦CO2?⑧HBr?⑨CO.
A.①②③④⑥⑧⑨
B.①②④⑥⑦⑨
C.①②④⑤⑥⑦⑧
D.全部
参考答案:浓硫酸具有酸性、吸水性、脱水性、强氧化性,所以不能干燥具有碱性、能和其反应的气体.
③H2S有强还原性能和浓硫酸发生氧化还原反应;?⑤NH3?是碱性气体;?⑧HBr具有强还原性,能和浓硫酸发生氧化还原反应.?
故选B.
本题解析:
本题难度:简单