1、实验题 (12分)下图为学生设计的制取溴苯的装置。
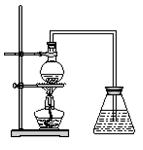
(1)图中的错误之处有?处。
(2)往烧瓶中依次加入铁粉、苯和?。
(3)与烧瓶中连接的垂直向上的导管的作用是?。
(4)烧瓶中发生反应的化学方程式为_______________。
(5)反应完毕后,向锥形瓶中的溶液中滴入AgNO3溶液,现象为?。
(6)反应完毕后,将烧瓶中橙红色的液体倒入盛有足量Na OH的烧杯中,充分振荡,静置,分液得无色油状产品,写出离子方程式?。
2、实验题 硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
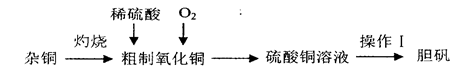
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。

烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
3、实验题 (12分)三草酸合铁酸钾晶体K3[Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1 NaOH、3%H2O2、0.1mol·L-1KI、0.1mol·L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是?。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是?,现象是?
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:?;假设2:?;假设3:?。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
实验步骤
| 预期现象与结论
|
步骤1:
| ?
|
步骤2:
| ?
|
步骤3:
| ?
|
……
| ?
4、实验题 在没有现成的CO2气体发生器的情况下,请你选用下图所示部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。

(1)应选用的仪器是________________(填入编号);
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案,应选用的药品是________?_________。
5、填空题 某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
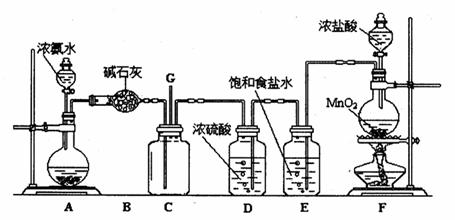
请回答下列问题:?
(1) F中发生反应的化学方程式为?;
(2)C中发生的反应为:8NH3 + 3Cl2===? N2 + 6NH4Cl ,其中氧化剂与还原剂的物质的量之比为?;当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为?mol-1(用含a、b的代数式表示);
(3) 将F制得的氯气通人含74g Ca(OH)2的石灰乳中,最多可制得漂白粉?g。
|