1、实验题 (12分)下图为学生设计的制取溴苯的装置。
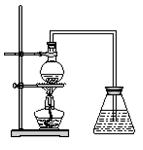
(1)图中的错误之处有?处。
(2)往烧瓶中依次加入铁粉、苯和?。
(3)与烧瓶中连接的垂直向上的导管的作用是?。
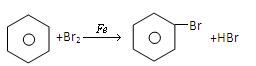
(4)烧瓶中发生反应的化学方程式为_______________。
(5)反应完毕后,向锥形瓶中的溶液中滴入AgNO3溶液,现象为?。
(6)反应完毕后,将烧瓶中橙红色的液体倒入盛有足量Na OH的烧杯中,充分振荡,静置,分液得无色油状产品,写出离子方程式?。
参考答案:(2×6=12分)
(1)2?(2)液(纯)溴?(3)冷凝迴流
(4)
(5)生成浅黄色沉淀?(6)Br2+2OH—=Br —+BrO—+H2O
—+BrO—+H2O
本题解析:略
本题难度:简单
2、实验题 硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
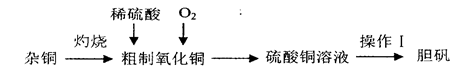
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。

烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
参考答案:(16分)(1)蒸发浓缩(2分);冷却结晶(2分) (2)ab(2分,选对1个1分,有错误不得分)
(3)CuO(2分,其它合理答案也可) Fe(OH)3(2分)
(4)Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(2分,写对1个即得2分) ①防止NaOH溶液倒吸进入发生装置(2分) ②NO、NO2有毒气体能被完全吸收(2分)
本题解析:(1)硫酸铜能溶于水,所以从硫酸铜溶液中得到硫酸铜晶体得操作应该是蒸发浓缩、冷却结晶,然后过滤烘干即可。
(2)灼烧后的产物除氧化铜还含少量铜,这说明a.灼烧过程中部分氧化铜被还原,a正确;b.灼烧不充分.铜未被完全氧化,b正确;c.氧化铜稳定,在加热过程中不可能分解生成铜,c不正确;d.铜极易被氧化生成氧化铜,d不正确,答案选ab。
(3)由于反应中不能再引入新的杂质,所以要调节溶液的pH小于进入氧化铜或氢氧化铜。由于氢氧化铁沉淀的pH小于氢氧化铜沉淀的pH,所以首先生成氢氧化铁沉淀,过滤得硫酸铜溶液。
(4)硝酸具有强氧化性,能把铜氧化生成硝酸铜,但随着反应的进行,硝酸浓度逐渐降低,其还原产物将逐渐变为NO,因此有关反应的化学方程式是Cu+4H++2NO3-=Cu2++2H2O+2NO2↑、3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。由于NO2与氢氧化钠溶液反应时,溶液容易倒吸,且NO与氢氧化钠溶液不反应,易造成环境污染,所以图2中通入氧气可以氧化NO而不完全吸收,即装置2的优点是①防止NaOH溶液倒吸进入发生装置;②NO、NO2有毒气体能被完全吸收。
本题难度:一般
3、实验题 (12分)三草酸合铁酸钾晶体K3[Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1 NaOH、3%H2O2、0.1mol·L-1KI、0.1mol·L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是?。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是?,现象是?
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:?;假设2:?;假设3:?。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
实验步骤
| 预期现象与结论
|
步骤1:
| ?
|
步骤2:
| ?
|
步骤3:
| ?
|
……
| ?
参考答案:(1)CO2、CO?
(2)焰色反应透过蓝色钴玻璃,观察到紫色的火焰
(3)①FeO、Fe? FeO?Fe
实验步骤
预期现象与结论
步骤1:取适量固体产物与试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解。分离不容固体与溶液,用蒸馏水充分洗涤不溶固体
固体产物部分溶解
步骤2:向试管中加入适量硫酸铜溶液,再加入少量不溶固体,充分振荡
若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。
若蓝色溶液颜色明显改变,且有暗红色固体生成,则证明有铁单质存在
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体与试管中,滴加过量HCl,静置,取上层清液,滴加适量H2O2 ,充分振荡后滴加KSCN
结合步骤2中的(2):
若溶液基本无色,则假设(1)成立
若溶液呈血红色,则假设(3)成立
③步骤1:将固体产物加入1.0 mol·L-1盐酸中观察有无气体若有气泡产生、说明固体产物中含有单质铁,反之,则不含单质铁
步骤2:将固体产物加入足量的0.1 mol·L-1CuSO4中充分反应后过滤、洗涤后,将沉淀物溶于1.0 mol·L-1盐酸,再加入20% KSCN,最后加入3%? H2O2,若最终溶液显红色,说明固体产物中含有FeO,若不出现红色、说明不含有FeO
本题解析:(1)澄清石灰水(A)变浑浊,说明气体产物中含有CO2;
澄清石灰水(C)变浑浊、B中有红色固体生成,说明气体产物中含有CO:
CO+CuO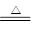 Cu+CO2? Ca(OH)2+CO2=CaCO3↓+H2O Cu+CO2? Ca(OH)2+CO2=CaCO3↓+H2O
(2)钾元素一般通过焰色反应来检验:透过蓝色钴玻璃,观察到紫色的火焰
(3)固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3,说明铁只能以0价、+3价的形式存在,故只可能是FeO、Fe两种存在形式,有三种假设:假设1:FeO、Fe;假设2:FeO;假设3:Fe
其中的铁可通过与盐酸反应有无气体生成、与蓝色硫酸铜溶液是否有铜析出(溶液颜色的改变)来判定
FeO的检验:用盐酸将其溶解后,加入KSCN溶液,再用双氧水将其氧化,观察溶液是否变红
本题难度:一般
4、实验题 在没有现成的CO2气体发生器的情况下,请你选用下图所示部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。

(1)应选用的仪器是________________(填入编号);
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案,应选用的药品是________?_________。
参考答案:(1)a、c、d、e (2)浓硝酸、水、块状大理石
本题解析:(1)根据二氧化碳的反应原理和反应物的状态,其反应发生装置需要组成“固液不加热型”,按照此思路去选择仪器。由于题目要求装配成一个能随开随闭的二氧化碳气体发生装置,因此可以根据启普发生器的特点来进行选择,则盛固体药品的反应容器选择e,液体盛放在烧杯d中,通过弹簧夹来控制反应的进行与否,所以选择的仪器是a、c、d、e。(2)根据(1)的装置可以知道应该选择稀盐酸和块状的大理石来制取二氧化碳。2制备实验装置的选择
点评:该题是基础性试题的考查,主要考查了常用气体的发生装置和收集装置的选取方法,有利于调动学生的学习兴趣,激发学生的学习积极性。答题要注意如果不是典型的实验仪器,尽量选择合适的仪器。
本题难度:一般
5、填空题 某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
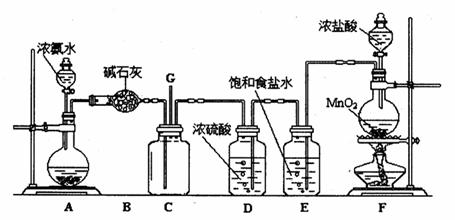
请回答下列问题:?
(1) F中发生反应的化学方程式为?;
(2)C中发生的反应为:8NH3 + 3Cl2===? N2 + 6NH4Cl ,其中氧化剂与还原剂的物质的量之比为?;当a mol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗数常数为?mol-1(用含a、b的代数式表示);
(3) 将F制得的氯气通人含74g Ca(OH)2的石灰乳中,最多可制得漂白粉?g。
参考答案:
(1)? MnO2 + 4HCl(浓)  MnCl2 +Cl2↑+2H2O MnCl2 +Cl2↑+2H2O
(2)? 3:2 ?b/2a
(3)? 127
本题解析:(1)F中是浓盐酸与二氧化锰反应制得氯气的反应。(2)氨气中氮元素从-3价升高到0价,作还原剂。但是8个氮原子中只有两个变价。而氯气全部都变成了氯化铵,所以氧化剂与还原剂之比为3:2。(3)a mol氯气反应,则转移的电子为2a mol ,而电子总数为b个,则阿伏伽德罗常数为b/2a。(3)74g的 Ca(OH)2物质的量为:1mol,则漂白粉主要成分为次氯酸,则次氯酸为1mol,共127g。
点评:本题涉及到了两个重要气体的制备实验,本题在实验装置上没有设置问题,而在方程的关于物质的量计算上有问题设置。其中利用到了元素守恒,电子得失守恒来计算。
本题难度:一般
|