1、填空题 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)="2NO(g)" △H=+180.5 kJ/mol?
2C(s)+ O2(g)="2CO(g)" △H="-221.0" kJ/mol
C(s)+ O2(g)=CO2(g) △H="-393.5" kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)?△H=?。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________________。
②在该温度下,反应的平衡常数K =?。(只写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明?(填字母)。
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平衡时至少有一种反应物的百分含量较小
D.该反应在一定条件下能自发进行
E.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是?。
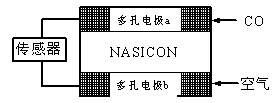
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
参考答案:(1)-746.5 kJ/mol(2)①1.88×10-4 mol/(L·s) 5000?③BCD?(3)B
本题解析:略
本题难度:简单
2、选择题 在一定温度下,可逆反应A(g)+3B(g)═2C(g)达到平衡的标志是( )
A.C的生成速率与B的分解速率相等
B.A、B、C分子数比为1:2:3
C.A、B、C的浓度不再随时间改变
D.单位时间内生成nmolA,同时生成3nmolB
参考答案:A、同一种物质的生成速率与分解速率相等是平衡状态,不同种物质的生成速率与分解速率等于计量数之比时是平衡状态,故A错误;
B、达平衡时,A、B、C三种物质的分子数之比可能是1:3:2,也可能不是1:3:2,与反应开始时加入的A、B物质的量及物质转化率有关,故B错误;
C、在一定条件下的可逆反应里,达到平衡状态时,反应混合物中各组成成分的浓度保持不变,故C正确;
D、生成n mol A,同时生成3n mo1B,都表示逆反应速率,无论反应是否达到平衡,这个关系总是成立的,反应方向一致,故D错误;
故选C.
本题解析:
本题难度:简单
3、填空题 恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g)?xC?(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol?L-1?s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%.
(1)x=______;
(2)从反应开始到40s达平衡状态,A的平均反应速率为______;
(3)平衡时容器中B的体积分数为______;
(4)该温度下此反应的平衡常数表达式为______数值是______;
(5)下列各项能表示该反应达到平衡状态是______
A.消耗A的物质的量与生成D的物质的量之比为2:1 B.容器中A、B的物质的量?n(A):n(B)=2:1
C.气体的平均相对分子质量不再变化 D.压强不再变化 E.气体密度不再变化
(6)在相同温度下,若起始时c(A)=5mol?L-1,c(B)=6mol?L-1,反应进行一段时间后,测得A的浓度为3mol?L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)______v(逆)(填“大于”“小于”或“等于”).
参考答案:(1)出A的物质的量变化量△n(A)=2mol-1.7mol=0.3mol,△n(C)=0.0225mol?L-1?s-1×10s×2L=0.45mol,根据物质的量变化量之比等于化学计量数之比,则0.3mol:0.45mol=2:x,解得x=3.
故答案为:3.
(2)40s时反应恰好处于平衡状态,此时B的转化率为20%,参加反应的B的物质的量为2mol×20%=0.4mol,由方程式可知,参加反应的A的物质的量为2×0.4mol=0.8mol,故v(A)=0.8mol2L40s=0.01mol?L-1?s-1.
故答案为:0.01mol?L-1?s-1.
(3)平衡时参加反应的B的物质的量为2mol×20%=0.4mol,则:
? ?2A(g)+B(g)?3C?(g)+D(s),
开始(mol):2? 2? 0? 0
变化(mol):0.8? 0.4? ?1.2? 0.4?
平衡(mol):1.2? 1.6? 1.2? 0.4
故平衡时B的体积分数为1.6mol1.2mol+1.6mol+1.2mol×100%=40%
故答案为:40%.
(4)可逆反应2A(g)+B(g)?3C?(g)+D(s)的平衡常数k=c3(C)c2(A)?c(B);
由(3)中计算可知,平衡时A、B、C、D的浓度分别为1.2mol2L=0.6mol/L,1.6mol2L=0.8mol/L,1.2mol2L=0.6mol/L,所以平衡常数k=c3(C)c2(A)?c(B)=0.630.62×0.8=0.75.
故答案为:c3(C)c2(A)?c(B);.
平衡常数指生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
计算出平衡时各组分的浓度,代入平衡常数表达式计算平衡常数.
(5)A.反应自始至终A与D都按物质的量之比2:1进行,不能说明反应到达平衡,故A错误;
B.平衡时A、B的物质的量关系,与反应条件有关,即与物质的转化率有关,平衡时容器中A、B的物质的量?n(A):n(B)可能是2:1,可能不是2:1,不能说明反应到达平衡,故B错误;
C.气体的总的物质的量不变,随反应进行气体的质量减小,气体的平均相对分子质量减小,气体的平均相对分子质量不再变化,说明反应到达平衡状态,故C正确;
D.反应前后气体的物质的量不变,压强自始至终不变化,故D错误;
E.容器的容积不变,随反应进行气体的质量减小,气体密度减小,气体密度不再变化,说明反应到达平衡,故E正确.
故选:CE.
(6)若起始时c(A)=5mol?L-1,c(B)=6mol?L-1,反应进行一段时间后,测得A的浓度为3mol?L-1,则:
? ?2A(g)+B(g)?3C?(g)+D(s),
开始(mol/L):5?6? 0? 0
变化(mol/L):5-3=2?1?3?1?
一段时间(mol/L):3?5? 3? 1
所以浓度商Qc=3332×5=0.6<0.75,反应未达平衡状态,向正反应进行,故v(正)>v(逆).
故答案为:否;大于.
本题解析:
本题难度:简单
4、选择题 工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ?ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ?ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 molCH4和1.2 molNO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度
| ?时间/min
n/mol
| 0
| 10
| 20
| 40
| 50
|
T1
| n(CH4)
| 0.50
| 0.35
| 0.25
| 0.10
| 0.10
|
T2
| n(CH4)
| 0.50
| 0.30
| 0.18
| ……
| 0.15
|
下列说法不正确的是(?)
A.10 min内,T1时υ(CH4)比T2时小? B.温度:T1<T2
C.ΔH:a<0? D.平衡常数:K(T1)<K(T2)
参考答案:D
本题解析:A、10min内,T2反应的CH4多,T2反应速率大,正确;B、因为T2反应速率大,所以T1<T2[来,正确;T2温度高,平衡时CH4的物质的量大,平衡向逆反应方向移动,正反应放热,K(T1)>K(T2),C项正确,D项错误。
本题难度:一般
5、选择题 在一定温度下,将气体X和气体Y各0.16 mol充人10 L恒容密闭容器中,发生反应 X(g)+Y(g) 2Z(g)?△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g)?△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min
| 2
| 4
| 7
| 9
|
n( Y)/mol
| 0.12
| 0.11
| 0.10
| 0.10
|
?
下列说法正确的是
A.反应前2 min的平均速率v(Z)=2.0×10-3mo1·L-l·min-l
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下,此反应的平衡常数K =l.44
D.其他条件不变,再充人0.2 mol Z,平衡时X的体积分数增大
参考答案:C
本题解析:2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)=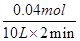 ?=0.002mol/(L·min),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(L·min)=0.004mol/(L·min),故A错误;该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),故B错误;由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:
?=0.002mol/(L·min),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(L·min)=0.004mol/(L·min),故A错误;该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),故B错误;由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:
X(g)+Y(g) 2Z(g)
2Z(g)
开始(mol):0.16? 0.16?0
变化(mol):0.06? 0.06? 0.12
平衡(mol):0.1? 0.1? 0.12
由于反应气体氢气的化学计量数相等,用物质的量代替浓度进行计算,故化学平衡常数k=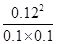 =1.44,故C正确;再通入0.2 mol Z,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,故D错误;所以选C。
=1.44,故C正确;再通入0.2 mol Z,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,故D错误;所以选C。
本题难度:一般