1、选择题 升高温度,下列数据不一定增大的是
A.化学反应速率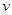
B.KNO3的溶解度S
C.化学平衡常数K
D.水的离子积常数Kw
参考答案:C
本题解析:A.在其它条件不变的情况下,升高温度化学反应速率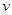 ?加快。不符合题意。错误。B.KNO3的溶解度S受温度的影响变化较大,升高温度,促进KNO3的溶解,所以KNO3的溶解度S增大。不符合题意。错误。C.化学平衡常数K只与温度有关。在其它条件不变的情况下,升高温度,化学平衡向吸热反应方向移动。如果可逆反应的正反应为放热反应,则升高温度,化学平衡向逆反应方向移动,K减小。如果可逆反应的正反应为吸热反应,则升高温度,化学平衡向正反应方向移动,K增大。所以升高温度化学平衡常数K。正确。D.水是弱电解质,升高温度,促进水的电离,水的离子积常数Kw增大。不符合题意。错误。
?加快。不符合题意。错误。B.KNO3的溶解度S受温度的影响变化较大,升高温度,促进KNO3的溶解,所以KNO3的溶解度S增大。不符合题意。错误。C.化学平衡常数K只与温度有关。在其它条件不变的情况下,升高温度,化学平衡向吸热反应方向移动。如果可逆反应的正反应为放热反应,则升高温度,化学平衡向逆反应方向移动,K减小。如果可逆反应的正反应为吸热反应,则升高温度,化学平衡向正反应方向移动,K增大。所以升高温度化学平衡常数K。正确。D.水是弱电解质,升高温度,促进水的电离,水的离子积常数Kw增大。不符合题意。错误。 、物质的溶解度S、化学平衡常数K、水的离子积常数Kw的影响。
、物质的溶解度S、化学平衡常数K、水的离子积常数Kw的影响。
本题难度:一般
2、选择题 可逆反应:2NO2
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
A.单位时间内生成nmolO2的同时生成2nmolNO2
B.单位时间内生成nmolO2的同时,生成2nmolNO
C.用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
D.混合气体的颜色发生改变的状态
参考答案:A、单位时间内生成nmolO2,同时生成2nmolNO2,说明反应v正=v逆,达到平衡状态,故A正确;
B、单位时间内生成nmolO2的同时生成2nmolNO,都是正反应速率,无论反应是否达到平衡状态,正反应速率之比等于化学计量数之比,不能说明达到平衡状态,故B错误;
C、反应达到平衡时的浓度与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故C错误;
D、混合气体的颜色改变,说明NO2气体的浓度变化,未达到平衡状态,故D错误;
故选:A.
本题解析:
本题难度:简单
3、选择题 在一定条件下,能说明可逆反应X(g)+Y(g)?Z(g)+W(g)已经达到平衡状态的是( )
A.容器内压强不随时间的变化而变化
B.X、Y、Z、W的浓度比保持不变
C.X的消耗速率与Z的生成速率相等
D.c(X)?c(Y)=c(Z)?c(W)
参考答案:A、反应两边气体的体积没有变化,压强始终不变,所以压强不变不能判断是否达到平衡状态,故A错误;
B、各组分的浓度不变,正逆反应速率相等,达到了平衡状态,故B正确;
C、表示的都是正反应速率,不能判断正逆反应速率是否相等,无法判断是否达到了平衡状态,故C错误;
D、物质的量浓度乘积大小无法判断浓度是否变化,无法判断是否达到了平衡状态,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 可逆反应达到化学平衡的标志是( )
A.正、逆反应不再进行
B.反应物的浓度为零
C.正、逆反应都还在继续进行
D.正、逆反应的速率相等
参考答案:A、反应达到平衡状态时,正逆反应速率相等但不等于0,反应处于动态平衡状态,故A错误.
B、反应达到平衡状态时,正逆反应速率相等但不等于0,反应处于动态平衡状态,所以反应物的浓度不为0,故B错误.
C、正逆反应都还在继续进行时,正逆反应速率不一定相等,所以不一定是平衡状态,故C错误.
D、反应达到平衡状态时,正逆反应速率相等但不等于0,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 可逆反应2SO2+O2?2SO3在恒温恒容下进行,能说明反应达到平衡的是( )
A.单位时间内消耗nmolSO2,同时生成nmolSO3
B.v逆(SO3)=2v正(O2)
C.容器内气体的密度保持不变
D.v(SO2)=v(SO3)
参考答案:A、单位时间内消耗n molSO2,同时生成n molSO3,表示的是正逆反应速率,但是不满足二者的化学计量数关系,说明正逆反应速率不相等,没有达到平衡状态,故A错误;
B、v逆(SO3)=2v正(O2),正逆反应速率相等,该反应达到了平衡状态,故B正确;
C、容器容积不变,气体的体积不变,反应两边都是气体,气体的总质量不变,根据ρ=mV,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故C错误;
D、v(SO2)=v(SO3),二者化学计量数相等,反应速率始终相等,无法判断正逆反应速率是否相等,故D错误;
故选B.
本题解析:
本题难度:一般