1、计算题 已知2.00% CuSO4溶液的密度为1.02 g·mL-1,欲配制500 mL这种溶液需用胆矾多少克?所得溶液的物质的量浓度是多少?
参考答案:15.94 g? 0.127 5 mol·L-1
本题解析:首先计算500 mL溶液中所含CuSO4的质量,然后再求出CuSO4·5H2O的质量
m(CuSO4)="500" mL×1.02 g·mL-1×2.00%="10.2" g
CuSO4?~? CuSO4·5H2O
160 g? 250 g
10.2 g? m(CuSO4·5H2O)
m(CuSO4·5H2O)="15.94" g
c(CuSO4)=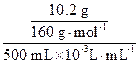 ="0.127" 5 mol·L-1
="0.127" 5 mol·L-1
本题难度:简单
2、选择题 下列仪器:①量筒?②表面皿?③烧杯?④试管?⑤容量瓶?⑥蒸发皿?⑦坩埚?⑧烧瓶,能直接用酒精灯加热的是
A.②③④⑥⑦⑧
B.③④⑥⑦⑧
C.④⑥⑦
D.④⑦⑧
参考答案:C
本题解析:①量筒不能加热;?②表面皿不能加热;?③烧杯需垫石棉网加热;?④试管可直接加热;?⑤容量瓶不能加热;?⑥蒸发皿直接加热;?⑦坩埚直接加热?⑧烧瓶垫石棉网加热;
本题难度:简单
3、选择题 下列实验步骤与实验事实的相应结论解释正确的是
选项
| 实验步骤与实验事实
| 结论解释
|
A
| Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解
| Mg(OH)2Ksp比Al(OH)3的小
|
B
| ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中
| CuS的Ksp比ZnS的小
|
C
| 在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成
| NH3在反应中作催化剂
|
D
| 单质硅不溶于浓硫酸和浓硝酸
| 硅被强氧化性酸钝化
参考答案:B
本题解析:A、Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解是因为Al(OH)3为两性氢氧化物,可与强碱NaOH溶液反应,错误;B、ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中是由于CuS的Ksp比ZnS的小,正确;C、在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成是因为二氧化碳与水和NH3反应生成的碳酸铵与BaCl2溶液反应生成碳酸钡沉淀,错误;D、单质硅不溶于浓硫酸和浓硝酸是由于单质硅性质稳定,与浓硫酸、浓硝酸不反应,错误。
本题难度:一般
4、实验题 (19分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
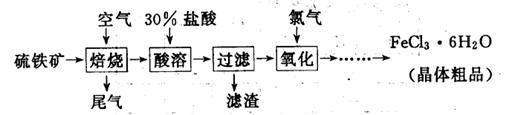
(1)氧化过程中发生反应的离子方程式是?,检验氧化生成的阳离子的试剂是?。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
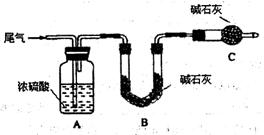
①C仪器的名称是?,该装置的作用是?。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理?,请说明理由?(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是?。
②进行沉淀洗涤的方法是?。
③SO2含量的表达式是?(用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括?、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因? . 6H2O晶体的操作包括?、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因? .
参考答案:(19分)
(1)2Fe2+ + Cl2= 2Cl- + 2Fe3+(2分)? KSCN溶液(1分,其它合理答案也给分)
(2)方案一:①干燥管(1分)?防止空气中的水蒸气、CO2被B装置吸收(2分)
②否(1分)?尾气中的CO2也能被B装置吸收使所测质量分数偏大(2分)
方案二:①使生成的SO42-完全转化为沉淀(2分)?
②在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作(2分)
③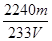 %(2分) %(2分)
(3)蒸发浓缩(2分)
Fe3+ + 3H2O  ?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解(2分) ?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解(2分)
本题解析:(1)滤液中含有Fe2+,通入Cl2发生氧化还原反应,离子方程式为:2Fe2+ + Cl2= 2Cl- + 2Fe3+;检验Fe3+的试剂为KSCN溶液,若溶液变红,说明含有Fe3+。
(2)方案一:①根据实验装置图可知,C仪器的名称是干燥管;外界空气中含有CO2、水分,可能被B中碱石灰吸收,所以C装置的作用是:防止空气中的水蒸气、CO2被B装置吸收。
②因为尾气中含有CO2,也能办碱石灰吸收,使所测质量分数偏大,所以方案一不合理。
方案二:①溴水与SO2反应生成H2SO4,加入过量的BaCl2溶液,Ba2+与SO42?反应,使生成的SO42-完全转化为沉淀。
②洗涤沉淀的方法是:在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作。
③根据化学方程式和S元素守恒可得对应关系:SO2~ BaSO4,所以SO2含量的表达式是:mg÷233g/mol×22.4L/mol÷VL×100% =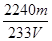 % %
(3)从FeCl3溶液中得到FeCl3 6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3+ + 3H2O 6H2O晶体,应蒸发浓缩,再冷却结晶、过滤,因为FeCl3为强酸弱碱盐,能发生水解反应:Fe3+ + 3H2O  ?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解。 ?Fe(OH)3 + 3H+,过量盐酸能够抑制Fe3+水解。
本题难度:一般
5、选择题 一些装有化学物质的容器上常贴有危险化学品的标志。下列标志中,应贴在装有浓硝酸的容器上的是(?)
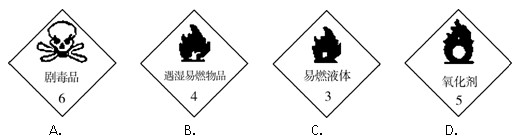 ? ?
参考答案:D
本题解析:略
本题难度:简单
|