1、选择题 某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO-与ClO3-的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1
参考答案:根据ClO-与ClO3-的浓度之比1:3,由Cl到ClO-,失去1个电子,由Cl到ClO3-,失去5个电子,一共失去1+3×5=16个电子;由Cl到Cl-,得到1个电子,需要16个原子才能得到16个电子,所以,被还原的氯元素与被氧化的氯元素的物质的量之比=16:(1+3)=4:1.
故选:D.
本题解析:
本题难度:一般
2、计算题 某研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,锰化合物的还原产物都是MnCl2(如:K2MnO4+8HCl= MnCl2+2Cl2↑+2KCl+4H2O)。他们又进行了以下一些有关定量的实验,按要求填空或计算(气体体积都折合成标准状况):
(1)称取了31.6gKMnO4粉末,放在试管中加热充分反应后,收集到气体的体积是?;另取31.6gKMnO4粉末和足量盐酸反应,收集到气体体积是?。
(2)将31.6gKMnO4粉末加热一段时间,收集到1.12L气体后停止加热,冷却后放入足量的浓盐酸再加热,又收集到气体体积是?。
(3)将a molKMnO4粉末加热一段时间,收集到V1L气体后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2L。则V2=?
(用a、V1表达)。
参考答案:(1)11.2L(2分);5.6L(2分)(2)8.96L(2分)(3)V2=56a —2V1(2分)
本题解析:
(1)?2KMnO4====K2MnO4+MnO2+O2↑ 2KmnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
直接代入计算即得,很容易。
(2)?将31.6gKMnO4粉末加热一段时间,收集到1.12L气体肯定是氧气,后停止加热,冷却后放入足量的浓盐酸再加热,又收集到气体体积是氯气,如列方程式计算很容易出错,我们可以用得失电子守恒来算:生成1.12L氧气失4×0.05mole,假设生成XmolCl2,则失去2×Xmole,而KMnO4最终生成Mn2+得到5 ×0.2=1mole,0.2+2X=1,X=0.4,即8.96L
(3)?还是用得失电子守恒来算:将a molKMnO4粉末加热一段时间,收集到V1L气体肯定是氧气,后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2L肯定是氯气。则V1/22.4×4+ V2/22.4×2=5 a, V2=56a —2V1
本题难度:一般
3、实验题 (11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
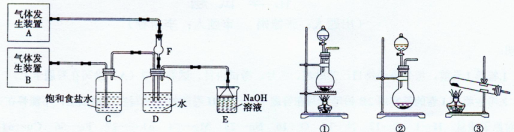
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是?;气体发生装置B应选择①、②、③三种装置中的?(选填序号)。
(2)D装置中主要反应的离子方程式为:?。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有?(试剂名称,下同)的试管中,再加入产生的现象是?,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有?的试管内,产生的现象是?。
参考答案:

本题解析:
⑴防倒吸?制Cl2选 ①?⑵Cl2+SO2+2H2O=4H++2Cl―+SO42―;⑶Cl2能将FeCl2氧化,SO2不能,所以选:氯化亚铁溶液,KSCN(C6H5OH)溶液,溶液呈红色或(紫色);酸性KMnO4溶液,紫色褪色。
本题难度:一般
4、填空题 (10分)下图所示反应I、反应II和反应III均是工业生产中常见的反应。其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同。
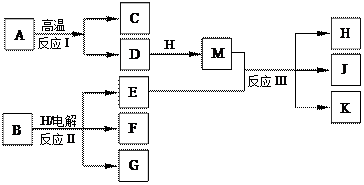
(1)C与J的水溶液反应后生成的含氧酸的电子式是?。
(2) E与G反应的离子方程式是?。
E与G反应的离子方程式是?。
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是?。
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果。
①用Na2S2O3标准溶液滴定I2时选用的指示剂是?。
②生成I2的反应的离子方程式是?。
参考答案:(10分,每空2分)
(1)
 ?
?
(2)Cl2 + 2OH- ?Cl-+ ClO-+ H2O
?Cl-+ ClO-+ H2O
(3)Ca(ClO)2 ="=" CaCl2 +O2↑
(4)①淀粉溶液?② ClO-+ 2I-+2H+=Cl-+ I2 + H2O
ClO-+ 2I-+2H+=Cl-+ I2 + H2O
本题解析:略
本题难度:一般
5、简答题 当我们轻轻拧开水龙头的时候,洁净的自来水“哗哗”流出时;你可曾想过自来水是怎样来的如图是中山市自来水公司生产工艺流程图:
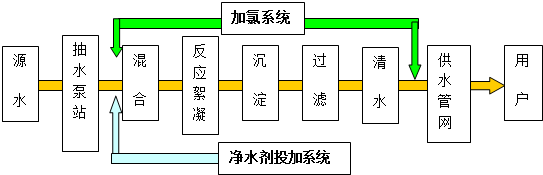
请回答下列问题:
(1)抽水泵站将源水抽起,加氯系统加氯,目的是______;
(2)常用______作净水剂;
(3)右图为过滤池,在实验室要完成过滤,需要的玻璃仪器有______、______、______.
参考答案:(1)依据流程分析,加氯系统加氯,目的是利用氯气和水反应生成盐酸和次氯酸,次氯酸具有强氧化性杀菌消毒,
故答案为:杀死水中的病菌;
(2)明矾在水溶液中水解生成的氢氧化铝胶体具有吸附悬浮在水中的杂质作用,所以常选择明矾做净水剂,
故答案为:明矾[或KAl(SO4)2?12H2O];
(3)过滤需要的玻璃仪器为漏斗、烧杯、玻璃棒,故答案为:漏斗;烧杯;玻璃棒.
本题解析:
本题难度:一般