1、选择题 电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCr4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l)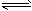
2PbCrO4(s)+2H+(aq) ΔH< 0 该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
[? ]
A.
B.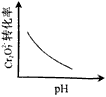
C.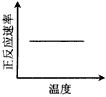
D.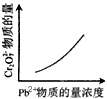
2、选择题 某温度下,在容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是?
2C(g)达到平衡时,A、B和C的物质的量分别为6mol、3mol和6mol。保持温度和压强不变,对平衡混合物中三者的物质的量作如下调整,可使平衡右移的是?
[? ]
A.均减半?
B.均加倍?
C.均增加2mol?
D.均减少2mol
3、填空题 某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体;
②Te和H2不能直接化合生成H2Te;
③氧气、硫、硒、碲与1 mol H2反应热如下表所示。
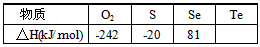
请回答下列问题:
(1)写出氧族元素中两种含18个电子的氢化物的化学式:___________、___________;
(2)写出硒化氢分解的热化学方程式:________________________;
(3)①一定温度下,在容积为1L的某容器中,充入2 mol SO2、1 molO2。最终达到平衡后,容器内压强变为原来的5/6,该温度下该反应的平衡常数为__________;
②在其他条件不变的情况下,将平衡后容器的体积压缩到原来的1/2,下列有关该体系的说法正确的是
________。
a.SO2的浓度减小
b.正反应速率加快,逆反应速率也加快
c.SO3的物质的量增加
d.重新平衡时,n(O2)/n(SO3)增大
4、选择题 一定量混合气体在密闭容器中发生如下反应:xA?+ yB(g)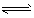 zC(g),达平衡后测得A气体的浓度为0.50 mol/L。恒温下将容器体积扩大1倍,反应重新达到平衡,测得A浓度为0.20mol/L。下列叙述中正确的是
zC(g),达平衡后测得A气体的浓度为0.50 mol/L。恒温下将容器体积扩大1倍,反应重新达到平衡,测得A浓度为0.20mol/L。下列叙述中正确的是
[? ]
A.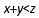
B.平衡向左移动
C.B的转化率减少
D.C的体积分数降低
5、填空题 (1)在固定体积的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)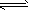 CO2(g)十H2(g) △H<0 此反应的平衡常数表达式K = ____________该温度下,根据下图计算此反应的平衡常数K =___________。升高温度后K值将__________(填“增大、减小或不变”)
CO2(g)十H2(g) △H<0 此反应的平衡常数表达式K = ____________该温度下,根据下图计算此反应的平衡常数K =___________。升高温度后K值将__________(填“增大、减小或不变”)
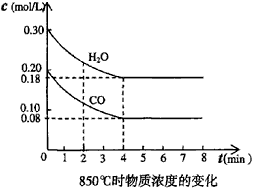
|
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
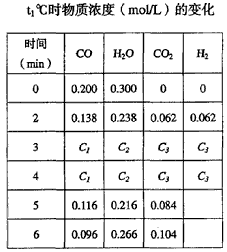
① 表中3min-4min之间反应处于_________状态; C2________0.18 mol/L (填“大于、小于或等于”)。 ② 反应在4min-5min间,平衡向逆方向移动,从以下选项选出可能的原因是________(单选)。表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.使用催化剂 b.增加氢气浓度 c.增加水蒸气 d.降低温度