1、选择题 各可逆反应到达平衡后,改变反应条件,其变化趋势正确的是
[? ]
A.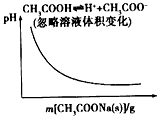
B.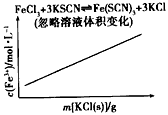
C.
D.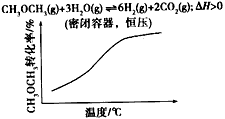
2、填空题 已知2X2(g)+Y2(g) 2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol
2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol
Y2, 在500℃时充分反应达平衡后Z的浓度为Wmol·L-1,放出热量bkJ。
(1)此反应平衡常数表达式为_________________;若将温度降低到300℃,则反应平衡常数将
___________(填增大、减少或不变)。
(2)若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量ckJ,则Z浓度_______Wmol·L-1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
(3)能说明反应已达平衡状态的是___________________。
A. 浓度c(Z)=2c(Y2)
B. 容器内压强保持不变
C. v逆(X2)=2v正(Y2)
D. 容器内的密度保持不变
(4)若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将___________(填“变大”、“变小”或“不变”) 。
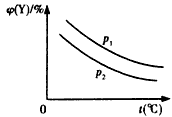
3、选择题 已知可逆反应:X(s)+aY(g)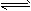 bZ(g) △H,反应达到平衡时,温度、压强对可逆反应的影响如图所示(图中p为压强,其中P1>P2)。下列有关判断正确的是
bZ(g) △H,反应达到平衡时,温度、压强对可逆反应的影响如图所示(图中p为压强,其中P1>P2)。下列有关判断正确的是
[? ]
A.可逆反应的焓变△H<0
B.反应的化学计量数a<b
C.该可逆反应的平衡常数
D.温度、压强不变,若使用合适的催化剂,可以提高Y的转化率
4、填空题 汽车尾气中的CO和氮氧化物对环境的危害较大,必须在排放前进行有效处理,下列是在汽车尾气处理装置中发生的一个反应: 2CO( g) +2NO( g) N2 (g) +2CO2 ( g) 。
N2 (g) +2CO2 ( g) 。

(1)如图为反应过程中的能量变化曲线,则该反应的△H ___(填“>”、“=”或“<”)0。
(2)该反应的化学平衡常数表达式为____,若升高温度,平衡常数K值将___(填 “增大”、“减小”或“不变”)。
(3)在实验室模拟尾气处理的实验中,下列措施可以提高尾气转化率的是___ 。
A.增大CO2浓度
B.降温
C.改用更高效的催化剂
D.在恒温恒容条件下,充入He气体
(4)若尾气中的另一种有害气体NO2也可发生类似转化反应,写出它的转化反应的化学方程式___ 。
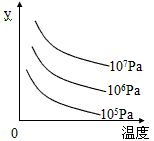
5、选择题 某可逆反应L (s)+G(g) 3R(g);ΔH>0。下图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
3R(g);ΔH>0。下图表示外界条件,即温度、压强的变化对上述反应的影响。试判断图中y轴可以表示
[? ]
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率