1、选择题 下列各组离子或分子一定能在溶液中常量共存的是
A.K+、NH 、SO
、SO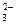 、HClO
、HClO
B.Na+、CO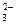 、SO
、SO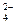 、AlO
、AlO
C.Al3+、Ba2+、NH3·H2O、Cl-
D.Fe3+、Fe2+、SCN-、Cl-
参考答案:B
本题解析:略
本题难度:一般
2、选择题 标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
A.①=②=③=④
B.①=②=③>④
C.①=②=③<④
D.④>①=②>③
参考答案:B
本题解析:气体的体积相等,相同条件下气体的物质的量相等,令气体的物质的量为3mol,则烧瓶的容积为3×22.4L。再判断烧瓶中溶液的体积、溶质的物质的量,再根据物质的量浓度公式判断浓度比。
①纯净的氨气,完全溶于水,溶液的体积等于烧瓶容积,所以溶液浓度为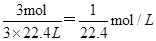 ;②混有1/3体积空气的氯化氢气体,氯化氢为1mol,溶液体积等于烧瓶容积的1/3,所以溶液物质的量浓度为
;②混有1/3体积空气的氯化氢气体,氯化氢为1mol,溶液体积等于烧瓶容积的1/3,所以溶液物质的量浓度为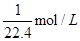 ;③纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的2/3,所以溶液的物质的量浓度为
;③纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的2/3,所以溶液的物质的量浓度为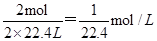 ;④混有少量O2的NO2气体,把NO2分成两部分:第一部分:4NO2+O2+2H2O=4HNO3,由于O2很少,故还有:第二部分:3NO2+H2O=2HNO3+NO.这样第一部分反应中,5份的气体(4NO2+O2)生成4份HNO3,这部分溶液体积等于二氧化氮与氧气的体积,故这部分的浓度为
;④混有少量O2的NO2气体,把NO2分成两部分:第一部分:4NO2+O2+2H2O=4HNO3,由于O2很少,故还有:第二部分:3NO2+H2O=2HNO3+NO.这样第一部分反应中,5份的气体(4NO2+O2)生成4份HNO3,这部分溶液体积等于二氧化氮与氧气的体积,故这部分的浓度为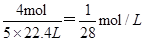 。第二部分浓度为=
。第二部分浓度为=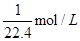 ,所以比只有NO2气体形成的溶液浓度小,故溶液浓度①=②=③>④,答案选B。
,所以比只有NO2气体形成的溶液浓度小,故溶液浓度①=②=③>④,答案选B。
点评:该题是中等难度的试题,试题综合性强,侧重对学生能力的培养。该题的 关键是明确喷泉实验原理、物质的量浓度的计算依据,然后结合题意灵活运用即可。难点是选项④,注意④中把整体分为两部分考虑,关键是判断溶液体积与气体的体积关系。
本题难度:一般
3、简答题 某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl?-、NO3-六种离子中的几种.现进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深.
据此可以推断,该溶液中肯定不存在的离子是( )
A.I-、HCO3-、Cl-
B.Fe2+、HCO3-、NO3-
C.I-、HCO3-
D.Fe3+、I-、HCO3-
参考答案:某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl?-、NO3-六种离子中的几种.现进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色,发生3SCN-+Fe3+?Fe(SCN)3不能大量共存,说明原溶液中一定存在Fe3+,因Fe3+与I-能发生2Fe3++2I-=2Fe2++I2,所以一定不存在I-;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深,发生3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,说明原溶液中一定存在Fe2+、NO3-,因HCO3-+H+=H2O+CO2↑所以原溶液滴加盐酸加酸没有气体生成,所以一定不存在HCO3-,无法确定是否含有Cl-;
故选C.
本题解析:
本题难度:一般
4、选择题 在强酸性无色透明的溶液中可以大量共存的离子组是 (?)
A.K+、NO3ˉ、OHˉ、Clˉ
B.SO42-、Mg2+、NH4+、Na+
C.Iˉ、Ba2+、Mg2+、NO3ˉ
D.Clˉ、SCNˉ、K+、Fe3+
参考答案:B
本题解析:A不能,氢氧根离子不能在强酸性溶液中大量存在。
B可以。
C不能,在酸性条件下硝酸根离子表现出强氧化性,将氧化碘离子。
D不能,+3价铁离子要与SCNˉ离子生成络合离子。
本题难度:一般
5、选择题 在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.在水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、SO42-、Cl-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.NH4Cl溶液:K+、Na+、SO42-、AlO2-
D.
=0.1?mol/L的溶液:Na+、K+、SiO32-、NO3-
参考答案:A.水电离出的c(H+)=1×10-12mol/L的溶液,为酸或碱溶液,酸溶液中该组离子不反应能共存,但碱溶液中NH4+、OH-结合生成弱电解质,而不能共存,故A不选;
B.使pH试纸呈红色,显酸性,I-、NO3-发生氧化还原反应而不能共存,故B不选;
C.NH4Cl溶液铵根离子水解,而AlO2-促进铵根离子的水解,则不能共存,故C不选;
D.KwC(H+)=0.1?mol/L的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子在碱性溶液中不反应,则能够共存,故D选;
故选D.
本题解析:
本题难度:简单