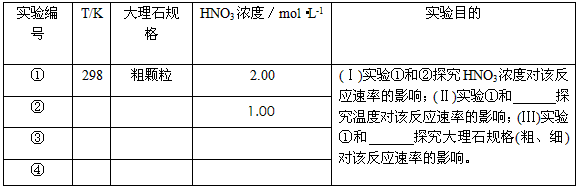
1、实验题 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
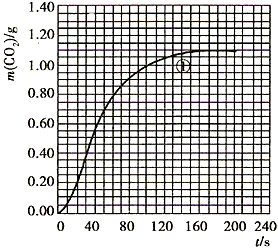
(2)实验①中CO2质量随时间变化的关系见下图
依据反应方程式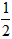 CaCO3+HNO3==
CaCO3+HNO3== Ca(NO3)2+
Ca(NO3)2+ CO2↑+
CO2↑+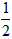 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
参考答案:(1) (2)70至90s内,CO2生成的质量为:m(CO2)=0.95g-0.84g=0.11g,
(2)70至90s内,CO2生成的质量为:m(CO2)=0.95g-0.84g=0.11g,
其物质的量为n(CO2)=0.11g÷44g·mol-1=0.0025mol,
根据方程式比例,可知消耗HNO3的物质的量为:n(HNO3)=0.0025mol×2=0.005mol,
溶液体积为25mL=0.025L,所以HNO3减少的浓度△c(HNO3)=0.2mol·L-1,
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=0.01mol·L-1·s-1。
本题解析:
本题难度:困难
2、选择题 某温度时,在体积为1 L的密闭容器中,A、B、C三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,B的体积百分含量与时间关系如图Ⅱ所示。则下列结论正确的是? ( )
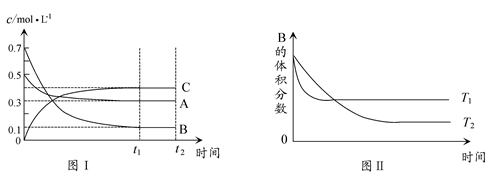
A.该反应的热化学方程式为:A(g )+3B(g) 2C(g) ΔH>0
2C(g) ΔH>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动?
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动?
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率增大
参考答案:C
本题解析:据图ⅡT1>T2,T1时B的转化率低,该反应为放热反应ΔH<0,A项错误。体积不变,通入稀有气体,混合气体浓度不变,平衡不移动,B项错误。该反应是气体体积缩小的反应,减小体积,平衡正向移动,C项正确。该反应为放热反应,升高温度,平衡逆向移动,A的转化率降低,D项正确。
本题难度:一般
3、选择题 稀硫酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成H2的总量。下列操作符合的是(?)
① 加Na2O2固体? ② 加H2O?③ 加H2C2O4晶体(乙二酸)? ④ CH3COONa 固体
⑤ NaNO3溶液?⑥ KCl溶液? ⑦ 加浓硫酸?⑧ 将铁粉改加等质量的铁片
A.②④⑤⑥
B.①②⑦
C.②③⑤
D.②④⑥⑧
参考答案:D
本题解析:过氧化钠溶于水生成氢氧化钠和氧气,氢氧化钠消耗稀硫酸,反应速率降低,但生成的氢气减少;稀释降低反应速率,且氢气不变,②正确;加入乙二酸,增大氢离子的浓度,且生成的氢气增加;醋酸钠和稀硫酸反应生成醋酸,降低氢离子的浓度,反应速率降低。但由于氢离子的物质的量不变,氢气不变,④正确;硝酸钠溶液也是相当于稀释,但在酸性条件下,NO3-具有氧化性,稀硝酸和铁反应得不到氢气;氯化钾溶液相当于是稀释,⑥正确;加入浓硫酸,增大氢离子的浓度,反应速率加快;将铁粉改加等质量的铁片,相当于是降低表面积,反应速率降低,且生成的氢气不变,⑧正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重考查学生基础知识的同时,侧重考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确外界条件是如何影响反应速率的,如何结合题意灵活运用、分析、判断即可。
本题难度:一般
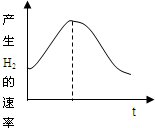
4、选择题 把镁条投入盛有盐酸的敞口容器中,产生氢气速率变化如图所示.下列因素中,影响反应速率的因素是( )
①盐酸的浓度?②镁条的表面积?③溶液的温度④Cl-的浓度.
A.①④
B.③④
C.①②③
D.②③