|
高考化学试题《化学反应速率》高频考点预测(2019年最新版)(八)
2019-05-30 04:56:42
【 大 中 小】
|
1、选择题 某学生用优质大理石与稀盐酸反应制取CO2,实验结果如图所示,对于该图的叙述正确的是( )
A.OA段因为盐酸浓度最大,所以该段反应速率最快
B.BC段表示反应速率最快,在该时间内收集到的气体最多
C.OC段表示随时间增加,反应速率逐渐增大
D.AB段反应快是因为反应放热导致的
| 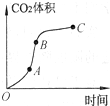
参考答案:优质大理石与稀盐酸反应制取CO2原理为:CaCO3+2HCl═CaCl2+H2O+CO2↑该反应为放热反应.现象为:大理石逐渐溶解,有无色无味可使澄清石灰水变浑浊的气体产生.结合图象可知:
A.OA段因为盐酸浓度最大,但刚开始反应,放出的热量少,所以该段反应速率,虽浓度大反应快,但温度低,综合比较,不是最快.从图象知,此时曲线斜率不是最大,故反应速率不是最快.故A错误.
B.BC段盐酸浓度逐渐减小,虽放出的热量多,从图象知,此时曲线斜率不是最大,故反应速率不是最快,但从BC段纵坐标知:在该时间内收集到的气体最多.故B错误.
C.OC段表示随时间增加,从图象知,此时曲线斜率不是增大,故反应速率不是逐渐增大.故C错误.
D.AB段,从图象知,此时曲线斜率最大,故反应速率最快,反应快是因为反应放热导致的.故D正确.
故选D.
本题解析:
本题难度:简单
2、选择题 10mL浓度为1mol?L-1的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的3mol?L-1的硫酸
B.加入适量蒸馏水
C.加入数滴硫酸铜溶液
D.加入适量的硫酸钠溶液
参考答案:A.加入适量的3mol.L-1的硫酸,增大氢离子的浓度,也增大了氢离子的物质的量,故A错误;
B.加入适量蒸馏水,氢离子的浓度减小,不改变氢离子的物质的量,化学反应速率减小,故B错误;
C.加入数滴硫酸铜溶液,Zn足量,构成Cu、Zn原电池,加快反应速率,且没有改变氢离子的物质的量,不影响生成的氢气的总量,故C正确;
D.加入适量的硫酸钠溶液,氢离子的浓度减小,不改变氢离子的物质的量,化学反应速率减小,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 在某一化学反应中,反应物A的浓度在20 s内从1.0 mol/L变为0.2 mol/L,则在这20 s内以A浓度的变化表示的平均反应速率为(?)
A.0.04 mol / (L·s)
B.0.04 mol / L
C.0.08 mol / (L·s)
D.0.08 mol / L
参考答案:A
本题解析:反应速率通常用单位时间内浓度的变化量来表示,则以A浓度的变化表示的平均反应速率为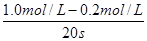 =0.04 mol / (L·s),答案选A。 =0.04 mol / (L·s),答案选A。
点评:该题是高考中的常见考点,属于常识性知识的考查。该题的关键是明确反应速率的含义以及计算依据,有利于培养学生的逻辑推理能力和规范答题能力。
本题难度:一般
4、选择题 反应C(固)+H 2O(气) CO(气)+H2(气)在一可变容积的闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(? ) CO(气)+H2(气)在一可变容积的闭容器中进行,下列条件的改变对其反应速率几乎无影响的是(? )
A.增加C的量
B.将容器的体积缩小一半
C.升温
D.保持压强不变,充入N2使容器体积变大
参考答案:A
本题解析:分析:对应反应C(s)+H2O(g) CO(g)+H2(g),有气体参加和生成,则温度、压强都能对化学反应速率产生影响,以此来解答. CO(g)+H2(g),有气体参加和生成,则温度、压强都能对化学反应速率产生影响,以此来解答.
解答:解:A、碳为纯固体,改变其用量,对化学反应速率无影响,故A选;
B、将容器的体积缩小一半,相当于压强增大,则反应速率加快,故B不选;
C、保持体积不变,升高温度,则反应速率加快,故C不选;
D、压强不变充入N2使容器体积增大,则相当于反应体系的压强减小,反应速率减小,故D不选;
故选A.
本题难度:一般
5、选择题 已知反应4NH3+5O2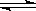 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( ) 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
A.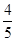 v(NH3)=v(O2) v(NH3)=v(O2)
B.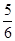 v(O2)=v(H2O) v(O2)=v(H2O)
C.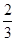 v(NH3)=v(H2O) v(NH3)=v(H2O)
D.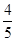 v(O2)=v(NO) v(O2)=v(NO)
| 