1、填空题 某学生用0.1×10×25㎜3,质量分数≥99.5%的铝片和酸反应制取H2,实验现象见下表:
| 1min | 2min | 5min | 15min | 20min
3mol/L?HCl
少量气泡
较多气泡
大量气泡
反应剧烈
铝片耗尽
1.5mol/L?H2SO4 | 均无明显现象(只有少量气泡)
|
(1)写出铝片与酸反应的离子方程式______.
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是______.
(3)根据铝片与盐酸和硫酸反应现象的差异,深入思考,可作出如下猜想:
猜想一:______;猜想二:______.
2、选择题 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应是:A(g)+xB(g)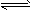 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是
[? ]
A. 8min前正反应速率大于逆反应速率
B. 20min时A的反应速率为0.05mol/(L·min)
C. 反应方程式中的x=1,正反应为吸热反应
D. 30min时降低温度,40min时升高温度
3、选择题 在2A+B = 3C+4D反应中,表示该反应速率最快的是?(?)
A.υ(A)="0.5" mol·(L·s)-1? B.υ(B)="0.3" mol·(L·s)-1
C.υ(C)="0.8" mol·(L·s)-1? D.υ(D)="1" mol·(L·s)-1
4、选择题 在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知2 v(B) ="3" v(A)、3 v(C)="2" v(B),则此反应可表示为
A.2A+3B=2C B.A+3B=2C C.3A+B="2C" D.A+B=C
5、填空题 (14分)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。?
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。?
(1)写出滴定过程中发生反应的化学方程式为???。?
(2)滴定过程中操作滴定管的图示正确的是???。
 ?
?
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度??(填“偏高”、“偏低”、或“不变”)。?
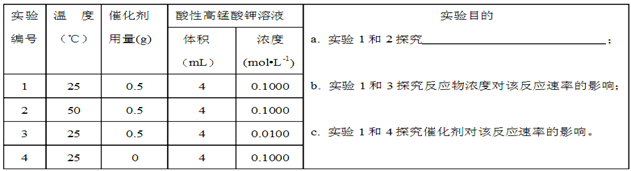
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1?。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
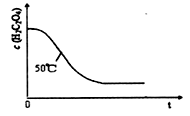
(4)写出表中a?对应的实验目的???;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线?如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。?
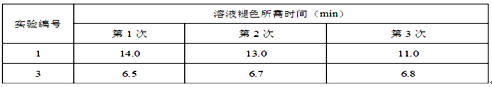
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):?
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案?______________________。?
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为??。