|
|
|
高中化学必备知识点《离子共存》试题预测(2019年最新版)(二)
2019-05-30 04:59:39
【 大 中 小】
|
1、选择题 某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
①pH=l的强酸溶液加水稀释后,溶液中各离子浓度一定减小
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3 COONa、b.C6H5 ONa、c.NaHCO3、d.NaOH,其溶液物质的量浓度由小到大的顺序为d<b<c<a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质溶液,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.③⑤⑥
B.③④⑥
C.④⑤⑥
D.①②④
参考答案:A
本题解析:①强酸溶液全部电离,加水稀释后,溶液中H+离子浓度一定都降低但氢氧根离子浓度增大,故①错误;pH=2的盐酸和pH=1的盐酸,c(H+)之比为1:10,故②错误;四种盐的水溶液均显碱性,同浓度,碱性强弱顺序为d>b>c>a,故pH相等的四种溶液物质的量浓度由小到大顺序为d、b、c、a,故③正确;④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,溶液中存在c(H+)+c(Na+)=2c(SO42-),则c(Na+)<2c(SO42-),故④错误;⑤水解和电离为可逆过程, , , ;则有Ka·Kh=Kw,故⑤正确;⑥当pH之和等于14时,则混合液pH=7,故⑥正确。综合以上分析,符合题意有③⑤⑥,所以选A。 ;则有Ka·Kh=Kw,故⑤正确;⑥当pH之和等于14时,则混合液pH=7,故⑥正确。综合以上分析,符合题意有③⑤⑥,所以选A。
本题难度:一般
2、选择题 下列溶液中微粒的物质的量浓度关系正确的是? (? )?
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
B.25℃时,pH =4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合液:
c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:
c(HCOO-)+c(H+)<c(Na+)+c(OH-)
D.0.1 mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:
| 2 c (CO32-)+2 c (HCO3-)+2 c (H2CO3)="3" c (Na+)
参考答案:A
本题解析:A项中性溶液c(OH-)=c(H+),c(Na+)>c(SO42-)>c(NH4+)>c(OH-)正确
B项由电荷守恒可有c(CH3COO-)+c(OH-)=c(Na+)+c(H+),而c(CH3COOH)<c(Na+),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),B 错
C项混合后为HCOONa和HCOOH的混合溶液,显酸性c(H+)>c(OH-),c(HCOO-)>c(Na+),故应有c(HCOO-)+c(H+)<c(Na+)+c(OH-),C错
D项根据物料守恒有2 c (CO32-)+2 c (HCO3-)+2 c (H2CO3)="c" (Na+),c (CO32-)+c (HCO3-)+c (H2CO3)="c" (Na+),两式相加有3 c (CO32-)+3 c (HCO3-)+3 c (H2CO3)="2" c (Na+)
点评:注意物质中各离子物质的量之间的关系,从盐类的水解结合溶液的电荷守恒、物料守恒进行判断.
题目难度较大。
本题难度:简单
3、选择题 下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是( )
A.Fe3+、Cl-、Na+、SO42-
B.Al3+、Na+、CO32-、NO3-
C.Ag+、Na+、SO42-、NO3-
D.AlO2-、CO32-、K+、Na+
参考答案:A.该组离子之间不反应,能共存,故A不选;
B.因Al3+、CO32-相互促进水解而不能共存,加入过量NaOH溶液生成偏铝酸钠溶液,过量稀盐酸与CO32-生成水和气体,得到澄清溶液,故B选;
C.因Ag+、SO42-能结合生成沉淀,不能共存,加入过量NaOH溶液与Ag+反应生成沉淀,故C不选;
D.因该组离子之间不反应,能够共存,故D不选;
故选B.
本题解析:
本题难度:一般
4、选择题 下列各组离子在指定溶液中能大量共存的是(?)。
A.使酚酞变红色的溶液:Fe3+、Mg2+、SO42-、NO3-
B.KNO3的酸性溶液:Fe2+、Ca2+、Al3+、Cl-
C.常温下,由水电离出的c(H+)=1.0×10-10 mol·L-1的溶液:NH4+、Na+、SiO32-、CO32-
D.透明的溶液:Cu2+、Fe3+、NO3-、MnO4-
参考答案:D
本题解析:使酚酞变红色的溶液呈碱性,在碱性溶液中Fe3+、Mg2+不能大量存在,A错误;B项,溶液中有H+和NO3-,可将Fe2+氧化为Fe3+,B错误;C项,该溶液可能呈酸性,也可能呈碱性,在酸性溶液中SiO32-、CO32-不能大量存在,在碱性溶液中,NH4+不能大量存在,C错误。
本题难度:一般
5、填空题 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程?。
(2) H2O以??键结合(填极性键、非极性键、离子键)
(3)在pH=1的溶液中,①NH4+、Al3+、Br-、SO42-?② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是?(填序号)。
(4)在下列反应中,水仅做氧化剂的是?(填字母,下同),水既不做氧化剂又不做还原剂的是?。
A.Cl2+H2O=HCl+HClO
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2
|
(5)已知KH和H2O反应生成H2和KOH,反应中1mol KH
?(填失去,得到)
?mol电子?
(6)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为
??,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为
?。
参考答案:(15分) (1) 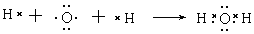 (2分)? (2)极性键(1分)?
(2分)? (2)极性键(1分)?
(3)①③?(2分)(4)CD(2分)? AB(2分)?(5)失去(1分)? 1(1分)
(6)H2 +2OH - -2e-=2H2O(2分)? 200NA (2分)
本题解析:(1)水是以极性键结合的共价化合物,则用电子式表示H2O的形成过程为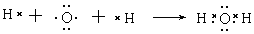 。
。
(3)溶液显酸性,则HCO3-不能大量共存。另外在酸性条件下,NO3-具有强氧化性,能氧化Fe2+,所以一定大量共存的是①③。
(4)在氧化还原反应中,氧化剂得到电子,元素的化合价降低。还原剂失去电子,元素的化合价升高,据此可知A、B中水水既不做氧化剂又不做还原剂的是,CD中水是氧化剂。
(5)KH中H元素的化合价是-1价,反应后变为0价,所以反应中1mol KH失去1mol电子。
(6)原电池中负极失去电子,则氢气在负极通入,电极反应式是H2 +2OH - -2e-=2H2O。生成1mol水转移2mol电子,1.8L水的物质的量是1800g÷18g/mol=100mol,所以反应中转移电子的个数是200NA。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的检验。该题主要是以水为载体,重点考查学生对电子式、氧化还原反应以及原电池原理的熟悉了解程度,意在巩固学生的基础,提高学生分析、归纳、总结问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
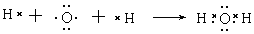 (2分)? (2)极性键(1分)?
(2分)? (2)极性键(1分)?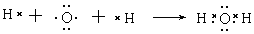 。
。