1、填空题 (12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理,常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
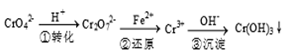
其中第①步存在下列平衡:2CrO42- (黄色) +2H+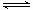 Cr2O72-(橙色) +H2O
Cr2O72-(橙色) +H2O
(1)若平衡体系的pH=2,该溶液显 色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同
B.2V(Cr2O72-)=V(CrO42-)
C.溶液的颜色不变
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡
Cr(OH)3(s) 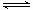 Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
Cr3+(aq)+3OH-(aq) Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32
常温下,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
方法2电解法:
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH )3沉淀。
(4)用Fe做电极的原因为 。
(5)在阴极附近溶液pH升高的原因(用电极反应式解释) ,溶液中同时生成的沉淀还有 。
参考答案:(1)橙色;(2) C;(3) 5;(4) 提供Fe2+作还原剂;(5) 2H++2e-=H2↑;Fe(OH)3
本题解析:(1)根据平衡移动原理:若平衡体系的pH=2,该溶液显强酸性,在酸性环境,平衡正向移动,因此溶液呈橙色;(2)A.Cr2O72-和CrO42-的浓度相同,溶液可能处于平衡状态,也可能处于非平衡状态,错误;B.在任何状态,都存在:V(Cr2O72-):V(CrO42-)=1:2;即V(CrO42-)=2V(Cr2O72-),因此不能说明该反应处于平衡状态,错误;C.若反应未达到平衡状态,则溶液的颜色会发生改变,因此溶液的颜色不变能说明第①步反应达平衡状态,正确;(3)Ksp Cr(OH)3="c" (Cr3+)?c3(OH-)=10-32,由于c(Cr3+)= 10-5mol/L,所以c3(OH-)=10-32÷10-5=10-27。c (OH-)=10-9;由于在溶液中存在水的电离平衡,c(H+)=10-5 mol/L。所以溶液的pH=5;该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。(4)用Fe做电极的原因为Fe作阳极发生氧化反应:Fe-2e-=Fe2+;Cr2O72-与Fe2+会发生氧化还原反应产生Cr3+;(5)溶液中的阳离子的放电能力:H+>Fe3+;在阴极上H+得到电子发生反应:2H++2e-=H2↑;使溶液中c(OH-)增大,所以阴极附近溶液pH升高;Fe3++3OH-= Fe(OH)3↓,所以溶液中同时生成的沉淀还有Fe(OH)3。
考点:考查化学平衡移动、反应平衡状态的判断、沉淀溶解平衡的应用、电解原理在污水处理的应用。
本题难度:困难
2、选择题 下表是3种物质的溶解度(20 ℃),下列说法中正确的是
物质
| MgCl2
| Mg(OH)2
| MgCO3
|
溶解度(g/100 g)
| 74
| 0.000 84
| 0.01
|
A.已知MgCO3的Ksp=6.82×10-6 mol2·L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)·c(CO32-)=6.82×10-6 mol2·L-2
B.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
C.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
D.用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
参考答案:C
本题解析:A、在碳酸镁饱和溶液中一定存在c(Mg2+)·c(CO32-)=6.82×10-6 mol2·L-2,但c(Mg2+)和c(CO32-)不一定相等,例如将碳酸镁溶解在氯化镁溶液中,二者就不相等,A错误;B、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH溶液,B错误;C、加入氯化镁溶液最终得到氢氧化镁,灼烧得到氧化镁。碳酸镁在溶液中加热最终得到氢氧化镁,灼烧得到氧化镁,C正确;D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+Mg(OH)2↓+2H2O,D错误,答案选C。
考点:考查溶度积常数的应用
本题难度:一般
3、选择题 欲使CaCO3在水溶液中溶解度增大,可以采用的方法是 (? )
A.1.0mol·L-1 Na2CO3
B.加入2.0mol·L-1 NaOH
C.0.10mol·L-1CaCl2
D.降低溶液的PH值
参考答案:D
本题解析:A、C两个选项由于同离子效应会降低CaCO3的溶解度。加入NaOH对的CaCO3溶解平衡无影响,只有D降低溶液的PH值会促进CO32-的水解,这样使CaCO3的溶解平衡向右移动,能增大的溶解度。
本题难度:简单
4、选择题 下表是三种难溶金属硫化物的溶度积常数(25 ℃)。
化学式
| FeS
| CuS
| MnS
|
溶度积
| 6.3×10-18
| 1.3×10-36
| 2.5×10-13
|
?
下列有关说法中正确的是(?)
A.25 ℃时,CuS的溶解度大于MnS的溶解度
B.25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S CuS↓+H2SO4不能发生
CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
参考答案:D
本题解析:FeS、CuS、MnS都是二价金属的硫化物,25 ℃时,CuS的Ksp远小于MnS的Ksp,说明CuS的溶解度小于MnS的溶解度;25 ℃时,饱和CuS溶液中,c(Cu2+)=c(S2-)=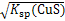 =
=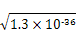 ?mol·L-1≠1.3×10-36 mol/L;因为CuS不溶于稀硫酸,所以反应CuSO4+H2S
?mol·L-1≠1.3×10-36 mol/L;因为CuS不溶于稀硫酸,所以反应CuSO4+H2S CuS↓+H2SO4可以发生;因为溶度积Ksp(CuS)<Ksp(FeS),所以Cu2+可与FeS反应生成更难溶的CuS。
CuS↓+H2SO4可以发生;因为溶度积Ksp(CuS)<Ksp(FeS),所以Cu2+可与FeS反应生成更难溶的CuS。
本题难度:一般
5、选择题 已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)= 2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
[? ]
A.AgCl>AgI>Ag2CrO4
B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI
D.Ag2CrO4>AgI>AgCl
参考答案:C
本题解析:
本题难度:一般