1、选择题 关于新材料新工艺的研究方兴未艾.下列有关说法正确的是( )
A.用煤制取二甲醚(CH3OCH3)替代石油,可以缓解我国石油的供需矛盾
B.非晶体铜不导电,Cu原子呈杂乱无章的非晶态排列,可与盐酸反应放出H2
C.纳米级CaCO3与盐酸反应比块状CaCO3慢
D.Mg与被保护金属形成原电池,Mg作正极被腐蚀
参考答案:A、因二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,可以缓解我国石油的供需矛盾,故A正确;
B、因铜与盐酸不反应,与铜的存在状态无关,非晶体铜与盐酸不反应,故B错误;
C、因固体的表面积越大,反应速率越快,纳米级CaCO3与盐酸反应比块状CaCO3快,故C错误;
D、因原电池中腐蚀的是负极,Mg作负极被腐蚀,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 在3H2 + N2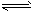 2NH3反应中,使用催化剂的理由是
2NH3反应中,使用催化剂的理由是
[? ]
A.使平衡向正反应方向移动
B.没有催化剂该反应不能发生
C.使化学反应速率增大
D.遏止逆反应的发生
参考答案:C
本题解析:
本题难度:一般
3、填空题 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
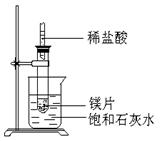
(1)实验中观察到的现象是
。
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)由此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量
参考答案:(1)向镁片表面产生气泡,逐渐减少;烧杯中有固体物质析出.
(2)镁跟盐酸反应产生氢气,并放出热量;Ca(OH)2的溶解度随温度的升高而变小.
(3)Mg+2H+
本题解析:
本题难度:一般
4、选择题 某同学用铝片和浓度为2 mol/L的稀硫酸10 mL反应来演示实验室制取氢气的原理,请分析下列措施对反应产生H2速率几乎无影响的是
A.改用98%的浓硫酸
B.改用铝粉
C.改加入2 mol/L的稀硫酸100 mL
D.加热
参考答案:C
本题解析:A中会发生钝化,B是增大反应物的接触面积,D是升高温度,反应速率均增大。C中硫酸的浓度不变,所以反应速率是不变的,答案选C。
本题难度:一般
5、选择题 室温下,下列反应的化学反应速率最慢的是
[? ]
A.H2+F2→HF
B.H2+N2→NH3
C.Ag++Cl-→AgCl
D.H++OH-→H2O
参考答案:B
本题解析:
本题难度:简单