1、选择题 科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下,下列说法错误的是
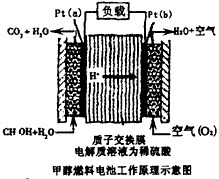
[? ]
A.a是负极,b是正极
B.b极的电反应是:O来源:www.91exam.org2+4H++4e-=2H2O
C.甲醇在a极上得电子,发生还原反应
D.当电路上通过2mol电子消耗的CH3OH为1/3mol
参考答案:C
本题解析:
本题难度:一般
2、简答题 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示.
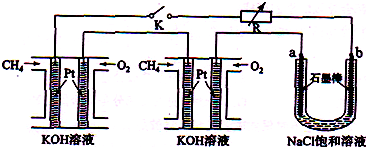
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为?、?.
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是?,电解氯化钠溶液的总反应方程式为?;
(3)若每个电池甲烷通如量为1L(标准状况),且反应完全,则理论上通过电解池的电量为?(法拉第常数F=9.65×l04C?mol-1列式计算),最多能产生的氯气体积为?L(标准状况).
参考答案:
本题解析:
本题难度:一般
3、填空题 (15分)2013年以来,我国多地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解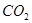 ,发生反应:
,发生反应: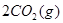 =2CO(g)+
=2CO(g)+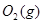 △H>0,该反应的
△H>0,该反应的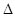 S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
S 0(填“>”“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
(2)活性炭可用于处理大气污染物NO。在1 L恒容密闭容器中加入0.100 mol NO和2.030 mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在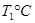 和
和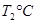 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表:
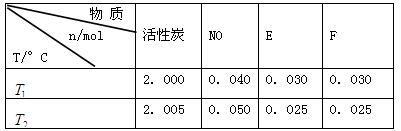
①请结合上表数据,写出NO与活性炭反应的化学方程式: 。
②上述反应在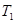 ℃时的平衡常数为
℃时的平衡常数为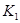 ,在
,在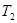 ℃时的平衡常数为
℃时的平衡常数为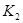 。
。
计算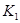 = 。根据上述信息判断,
= 。根据上述信息判断,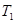 和
和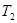 的关系是 。
的关系是 。
a.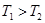 b.
b.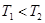 c.无法比较
c.无法比较
③在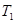 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
℃下反应达到平衡后,下列措施不能改变NO的转化率的是____。
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)碘循环工艺不仅能吸收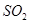 降低环境污染,同时又能制得氢气,具体流程如下:
降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出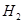 的目的是: 。
的目的是: 。
(4)开发新能源是解决大气污染的有效途径之一。直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
通过a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 。
参考答案:(15分)
(1) > 不能
(2)①C+2NO=N2+CO2 ②9/16 C ③a、b
(3) ①SO2+I2+2H2O = SO42-+2I-+4H+ ②降低生成物的浓度,使平衡向正方向移动
(4) 负 CH3OH-6e-+H2O = CO2 +6H+
本题解析:(1)根据化学反应可知,该反应是熵增的化学反应,所以△S>0,根据反应自发进行的判据,△ H-T△S<0反应能自发进行,该反应是熵增的吸热反应,在低温下不能自发进行。
(2)①根据活性炭可用于处理大气污染物NO,说明两者反应生成氮气和CO2,反应的化学方程式为C+2NO=N2+CO2;
②根据表格提供的信息,上述反应在T1℃时的平衡常数为K1(0.030×0.030)÷(0.040×0.040)=9/16,根据上述信息,没有温度大小,没有反应的热效应,无法比较T1和T2的关系,选c;③a.增大c( NO),相当于增大压强,平衡不移动,不能增大NO的转化率,b.该反应是反应前后气体体积不变的化学反应,增大压强,平衡不移动,不能增大NO的转化率,c.如果该反应是吸热反应,升高温度,平衡正向移动,能增大NO的转化率, d.移去部分F,平衡右移,能增大NO的转化率,选a、b。
(3)①根据流程图可知,SO2通入碘水中生成硫酸和氢碘酸,则反应器中发生反应的离子方程式为:SO2+I2+2H2O = SO42-+2I-+4H+,②根据化学反应2HI(g) I2(g)+H2(g),分离出H2,降低生成物的浓度,使平衡向正方向移动,加速碘的生成。
I2(g)+H2(g),分离出H2,降低生成物的浓度,使平衡向正方向移动,加速碘的生成。
(4)根据甲醇燃料电池的工作原理图可知,在a电极,失去电子,且H+由左向右迁移,所以a电极是负极,甲醇在负极失电子生成CO2和水,则电极反应式为CH3OH-6e-+H2O = CO2 +6H+。
考点:考查化学反应自发进行的判断,SO2污染的工业治理及甲醇燃料电池。
本题难度:困难
4、填空题 (10分)图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
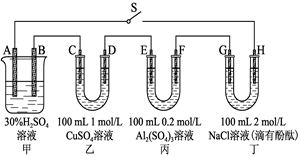
闭合S,发现G电极附近的溶液变红,20 min后,将S断开,此时C、D两极上产生的气体体积相同;据此回答:
(1)A电极的电极材料是______________(填“PbO2”或“Pb”)。
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是________(填化学式)。
(3)到20 min时,电路中通过电子的物质的量为________。
(4)0~20 min,H电极上发生反应的电极反应式为______________
参考答案:28(1)PbO2 (2) H2O (3)0.4mol; (4)2Cl--2e-=Cl2↑;4OH--4e-=O2+2H2O
本题解析:(1)闭合S,发现G电极附近的溶液变红,说明G的电极反应为2H2O+2e-=H2+2OH-,G为阴极,则H为阳极,A为正极,A电极的电极材料是PbO2;(2)丙中电解硫酸铝溶液,实际上是电解水,要使丙中溶液恢复到原来的浓度,需加入的物质是水;(3)20 min后,将S断开,此时C、D两极上产生的气体体积相同,设C、D产生气体的物质的量为xmol,
C极发生的电极反应为Cu2+ + 2e- =" Cu" 、2H+ + 2e- = H2↑,D极的电极反应为4OH— - 4e- = 2H2O + O2↑
0.1 0.2 2x x 4x x
0.2+2x="4x" 解得x="0.1" 则到20 min时,电路中通过电子的物质的量为0.4mol;
(4)0~20 min,H电极上发生反应的电极反应式为2Cl--2e-=Cl2↑;0.2moLCl-只放电0.2moL,随后是OH-放电,即4OH--4e-=O2+2H2O 。
考点:考查铅蓄电池,电解原理的应用。
本题难度:一般
5、选择题 有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(
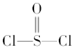
)中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
参考答案:A.锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B.该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,故B错误;
C.根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D.根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确.
故选D.
本题解析:
本题难度:简单