1、简答题 Na2SO4?10H2O的摩尔质量是______,483g?Na2SO4?10H2O中所含Na2SO4?10H2O的物质的量是______,所含Na+的物质的量是______,所含H2O分子的数目是______个.
参考答案:摩尔质量以g/mol为单位数值上等于其相对分子质量,Na2SO4?10H2O的相对分子质量为322,故Na2SO4?10H2O的摩尔质量是322g/mol,483g?Na2SO4?10H2O的物质的量是483g322g/mol=1.5mol,含有钠离子的物质的量为1.5mol×2=3mol,含有水分子的物质的量为1.5mol×10=15mol,水分子的数目为15mol×NAmol-1=15NA,
故答案为:322g/mol;1.5mol;3mol;15NA.
本题解析:
本题难度:一般
2、选择题 向50 g FeCl3的溶液中加入一小块钠,待反应完全后,过滤,得到仍有棕黄色的溶液45.9 g,则投入钠的质量为(?)
A.4.6 g
B.4.1 g
C.6.9 g
D.9.2 g
参考答案:C
本题解析:投入钠使溶液质量增加,但析出沉淀?Fe(OH)3及放出H2又使溶液质量减小,即减小的质量与增加的质量之差为50 g-45.9 g="4.1" g。根据化学方程式:
6Na+2FeCl3+6H2O====6NaCl+2Fe(OH)3↓+3H2↑
138 g? 214 g? 6 g
即每有138 g Na投入溶液中完全反应,生成214 g沉淀并放出6 g气体,质量减少?82 g,得关系式:
6Na?—?Δm
138? 82 g
m(Na)? 4.1 g
所以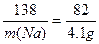
m(Na)="6.9" g
本题难度:简单
3、选择题 物质的量浓度相同的CaC12、AlC13两种溶液的体积之比是3:2,则两种溶液中C1-的物质的量之比是( )
A.1:2
B.3:2
C.1:1
D.2:3
参考答案:令CaC12、AlC13两种溶液的物质的量浓度为cmol/L,则:
CaC12溶液中C1-的物质的量浓度为cmol/L×2=2cmol/L,
AlC13溶液中C1-的物质的量浓度为cmol/L×3=3cmol/L,
CaC12、AlC13两种溶液的体积之比是3:2,则两种溶液中C1-的物质的量之比为2c×3:3c×2=1:1,
故选C.
本题解析:
本题难度:简单
4、填空题 (4分)1mol Na2SO4的质量为?克,含有?个氧原子,其水溶液的电离方程式为?。
参考答案:142g , 2.408×1024,? Na2SO4=2Na++SO42-
本题解析:略
本题难度:简单
5、选择题 设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
B.常温常压下,18 g H2O中含有的原子总数为3NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA
参考答案:
本题解析::选B A项,氯气与水的反应是一个可逆反应,0.1 mol氯气与水反应,转移的电子数小于0.1NA,A错;B项,正确;C项,标准状况下乙醇不是气体,C错;D项不是标准状况,常温常压下2.24 L CO和CO2混合气体中含有的碳原子数小于0.1NA,D错。
本题难度:一般