|
高考化学知识点整理《物质的量》高频试题特训(2019年最新版)(六)
2019-05-30 05:04:26
【 大 中 小】
|
1、选择题 同温同压下,同体积的CO和CO2,下列说法不正确的是
A.分子数之比等于1:1
B.原子数之比等于3:2
C.质量之比等于7:11
D.质子数之比等于7:11
|
参考答案:B
本题解析:根据阿伏伽德罗定律可知,在同温同压下,同体积的任何气体分子数相等,A.分子数之比等于1:1,正确;B.CO是双原子分子,CO2是三原子分子,原子数之比等于2:3,错误;C.根据m=n×M,质量之比等于28:44=7:11,正确;D.CO的质子数为14,CO2的质子数为22,质子数之比等,14:22=7:11,正确;选B。
考点:考查阿伏伽德罗定律及推论,化学计算等知识。
本题难度:一般
2、选择题 下列溶液中,跟100mL?1.0mol/L?NaCl溶液所含的Cl-物质的量相同的是( )
A.200mL0.25mol/LMgCl2溶液
B.200mL0.25mol/LAlCl3溶液
C.100mL1.0mol/LNaClO溶液
D.25mL1.0mol/LHCl溶液
参考答案:A、n(Cl-)=2n(MgCl2)=0.2L×0.25mol/L×2=0.1mol,故A正确;
B、n(Cl-)=3n(AlCl3)=0.2L×0.25mol/L×3=0.15mol,故B错误;
C、NaClO溶液中无Cl-离子,故C错误;
D、n(Cl-)=n(HCl)=0.025L×1.0mol/L=0.025mol,故D错误.
故选A.
本题解析:
本题难度:一般
3、填空题 某课题组进行实验研究时,欲配制浓度均为1.0mol?L-1 的Ba(OH)2和H2SO4溶液。
Ⅰ.该组同学在配制Ba(OH)2溶液时,只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(相对分子质量:315),发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
(1)用化学方程式解释未溶物产生的原因?
(2)某同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。据此认为即便使用纯净的Ba(OH)2·8H2O,在室温下也不能配得1.0 mol?L-1Ba(OH)2溶液,其理由是:
?
Ⅱ.用18 mol?L-1的浓硫酸配制450 mL 1.0 mol?L-1稀硫酸。
(3)实验时,需量取浓硫酸的体积为?mL,需用的主要仪器有量筒、烧杯、玻璃棒、?、?
(4)配制溶液时,定容的操作方法是:?
(5)实验中下列情况会使所配溶液浓度偏高的是?
A.洗涤量取浓硫酸的量筒2~3次,并将洗涤液转入容量瓶中
B.定容时仰视刻度线
C.振荡摇匀后再重新加水至刻度线
D.用水洗涤容量瓶未干燥
参考答案:(1)Ba(OH)2+CO2 =BaCO3+H2O(2分)
(2)室温下,Ba(OH)2饱和溶液的浓度只约为0.12 mol?L-1(2分)
(3) 27.8(2分),胶头滴管、500 mL容量瓶(2分)
(4)加水离刻度线1~2 cm,改用胶头滴管逐滴滴加至刻度线(2分)
(5) A (2分)
本题解析:(1)长期放在空气中氢氧化钡会与二氧化碳反应生成碳酸钡而出现浑浊。(2)室温下,溶解度为3.9g/100g水。n=".9g/315g/mol=0.012mol" 10000g水中应该溶解0.12mol,假设密度是1g/ml,所以浓度大约0.12mol/L,达不到1mol/L。(3)只能用500ml的容量瓶配置无450ml的容量瓶。所需主要仪器有量筒、烧 杯、玻璃棒、胶头滴管、500 mL容量瓶.(4)定容的操作方法是加水离刻度线1~2 cm,改用胶头滴管逐滴滴加至凹液面与刻度线相切。(5)量取浓硫酸的量筒不需要洗涤,制备量筒时误差已经考虑,否则溶质偏多结果偏高。仰视刻度线使加水多,所以浓度偏低。洗涤容量瓶没有干燥无影响。
本题难度:一般
4、选择题 200mL的某NaOH溶液,其中含有4g溶质.用此溶液配制0.2mol/L的NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1:6
B.1:4
C.2:1
D.2:3
参考答案:4gNaOH的物质的量为:4g40g/mol=0.1mol,
则该NaOH溶液的物质的量浓度为:0.1mol0.2L=0.5mol/L,
欲配制0.2mol/L?的NaOH溶液,设需0.5mol/L的NaOH溶液的体积为xL,蒸馏水的体积为yL,
忽略稀释时体积的变化,则混合后的体积为(x+y)L,
溶液稀释前后溶质的物质的量不变,
则有:xL×0.5mol/L=(x+y)L×0.2mol/L,
解之得:x:y=2:3,
故选D.
本题解析:
本题难度:简单
5、选择题 用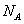 表示阿伏加德罗常数的值。下列判断错误的是(?) 表示阿伏加德罗常数的值。下列判断错误的是(?)
A.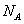 个 个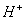 的质量为1 g 的质量为1 g
B.2 L 0.5mol/L 溶液中含 溶液中含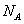 个 个
C.32 g 中含有 中含有 个氧原子 个氧原子
D.标准状况下,1 mol 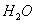 中含有 中含有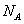 个水分子 个水分子
参考答案:B
本题解析: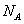 个 个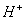 的物质的量是1mol,质量为1 g,A正确;2 L 0.5mol/L 的物质的量是1mol,质量为1 g,A正确;2 L 0.5mol/L 溶液中钠离子的物质的量是2L×0.5mol/L×2=2mol,所以含有2 溶液中钠离子的物质的量是2L×0.5mol/L×2=2mol,所以含有2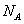 个 个 ,B不正确;32g氧气的物质的量是1mol,含有 ,B不正确;32g氧气的物质的量是1mol,含有 个氧原子,C正确;物质的量和状态无关系,所以标准状况下,1 mol 个氧原子,C正确;物质的量和状态无关系,所以标准状况下,1 mol 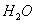 中含有 中含有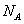 个水分子,D正确,答案选B。 个水分子,D正确,答案选B。
点评:阿伏加德罗常数是历年高考的“热点”问题,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
|