1、选择题 下列“化学与生活”的说法错误的是( )
A.硫酸钡可用作白色颜料
B.石膏可用来调节水泥的凝固时间
C.明矾可用于水的消毒、杀菌
D.醋可用于除去暖水瓶中的水垢
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列说法中正确的是
? [? ]
A.NaHCO3溶液中可以大量存在NO3-、Al3+、K+、SO42-等离子
B.t℃时,水的离子积常数为KW,则c2(OH-)=KW的水溶液一定呈中性
C.室温下0.1 mol/L的NaOH溶液与pH =1的某酸HA等体积混合后,溶液中c(Na+)≥c(A-)
D.1 mol/L的醋酸溶液加水稀释时,醋酸根离子的物质的量浓度与醋酸分子的物质的量浓度之比减小
参考答案:B
本题解析:
本题难度:一般
3、填空题 Ⅰ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:?N2(g)+3H2(g) 2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题
2NH3(g) 其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题

①比较K1、K2的大小:K1_______K2(填“>”、“=”或“<”)
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式____________________。
②盐酸肼水溶液中离子浓度的排列顺序正确的是______________(填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-);?
B.c(Cl-)>c([N2H5·H2O+])>?c(H+)>c(OH-);
C.c(N2H62+)+?c([N2H5·H2O+])+c(H+)=?c(Cl-)+c(OH-);?
D.c(N2H62+)>?c(Cl-)>c(H+)>c(OH-);
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
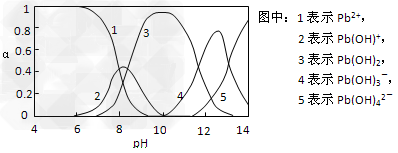
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)_________1/2(填“>”、“=”、“<”)
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为___________。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为________时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH?=?13时,混合体系中发生的主要反应的离子方程式为:_____________________。
参考答案:Ⅰ.(1)①>;②AC;(2 )① N2H62++H2O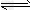 [N2H5·H2O]+ + H+;②A
[N2H5·H2O]+ + H+;②A
Ⅱ.(1)<;(2)PbCl2;(3)10;Pb(OH)3- + OH- = Pb(OH)42-
本题解析:
本题难度:一般
4、选择题 下列水溶液显酸性的是( )
A.硫酸钠溶液
B.碳酸氢钠溶液
C.碳酸钠溶液
D.氯化铁溶液
参考答案:D
本题解析:
本题难度:一般
5、选择题 对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
A.某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.0.1?mol?L-1(NH4)2SO4溶液中:c(H+)>c(NH4+)
C.0.1?mol?L-1的HCl溶液与0.1?mol?L-1的NaOH溶液等体积混合:c(H+)+c(Na+)=c?(OH-)+c(Cl-)
D.0.1?mol?L-1?CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:A.溶液呈电中性,溶液中阴阳离子所带电荷相等,则c(Cl-)+c(OH-)=c(NH4+)+c(H+),如果c(Cl-)>c(NH4+),则c(OH-)<c(H+),故A错误;
B.硫酸铵是强酸弱碱盐,铵根离子易水解,但水解程度较小,所以c(H+)<c(NH4+),故B错误;
C.0.1mol?L-1的HCl溶液与0.1?mol?L-1的NaOH溶液等体积混合,盐酸和氢氧化钠恰好完全反应生成氯化钠,溶液呈电中性,溶液中阴阳离子所带电荷相等,则c(H+)+c(Na+)=c?(OH-)+c(Cl-),故C正确;
D.醋酸钠是强碱弱酸盐,醋酸根离子易水解,钠离子不水解,所以c(Na+)>c(CH3COO-),醋酸根离子水解而使溶液呈碱性,所以c(OH-)>c(H+),醋酸根离子水解较微弱,所以c(CH3COO-)>c(OH-),故D错误;
故选C.
本题解析:
本题难度:简单