1、选择题 下列说法中正确的是
[? ]
A.元素周期律的本质是随着核电荷数的增加元素化合价呈周期性变化
B.核外电子排布的周期性变化是元素性质周期性变化的本质
C.元素周期表中可以把元素分成s、p、d、ds、f五个区
D.最外层电子数≤2的元素一定是金属元素
参考答案:BC
本题解析:
本题难度:简单
2、选择题 从下列实验事实中得到的结论,正确的是(双选) ( )。
选项
| 实验事实
| 结论
|
A
| 将纯铜片和另一种金属M用导线连接,同时插入稀硫酸中,铜片表面有气泡冒出
| 金属活动性:M>Cu
|
B
| 将SO2通入酸性KMnO4溶液中,红色褪去
| SO2有漂白性
|
C
| CO2通入苯酚钠溶液中,出现浑浊
| 酸性:苯酚<碳酸
|
D
| Cl2的水溶液可以导电
| Cl2是电解质
|
?
参考答案:AC
本题解析:SO2被酸性KMnO4溶液氧化而使KMnO4溶液褪色,故B错误;Cl2是单质,故D错误。
本题难度:一般
3、填空题 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:
(1)T元素的原子结构示意图为______,Q元素在元素周期表中的位置为______,R元素单质的电子式为______.
(2)原子序数比T少2的元素是______(填元素符号),用电子式表示该元素与W元素形成化合物的过程______.
(3)原子序数比W多4的元素是______(填元素符号),该元素最高价氧化物的水化物溶液与W元素最高价氧化物的水化物溶液反应的离子方程式为:______.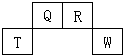
参考答案:图中所示是短周期元素Q、R、T、W在元素周期表中的位置,因为T所处的周期序数与主族族序数相等,所以可以知道T是Al,Q是C,R是N,W是S.
(1)铝元素的原子结构示意图为
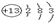
,C在周期表中的位置是第二周期ⅣA族,氮气是含有氮氮叁键的物质,电子式为:

,故答案为:
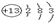
;第二周期ⅣA族;

;
(2)原子序数比Al少2的元素是Na,硫化钠是硫元素和钠元素之间通过离子键形成的离子化合物,形成过程表示为:
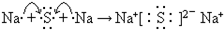
,故答案为:Na;
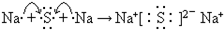
;
(3)原子序数比S多4的元素是Ca,该元素最高价氧化物的水化物是氢氧化钙,S元素最高价氧化物的水化物是硫酸,氢氧化钙是强碱,硫酸是强酸,二者之间发生中和反应生成硫酸钙和水,实质是:Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O,故答案为:Ca;Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O.
本题解析:
本题难度:一般
4、选择题 下列各组元素性质的递变规律错误的是
[? ]
A.Li、Be、B原子最外层电子数依次增多 ?
B.B、C、P元素的最高正化合价依次升高 ?
C.Si、P、S、C1原子半径依次增大 ?
D.Be、Mg、Ca、Ba的金属性依次增强
参考答案:C
本题解析:
本题难度:一般
5、推断题 A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。

(1)写出A、B、C三种元素的名称_______、________、________。
(2)B位于元素周期表中第______周期,第______族。
(3)C的原子结构示意图为________,C的单质与H2反应的化学方程式为_______________________。
(4)比较B、C的原子半径:B________C,写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式_________________。
参考答案:(1)氮;硫;氟
(2)三;ⅥA
(3)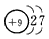 ;F2+H2===2HF
;F2+H2===2HF
(4)>;2NH3+H2SO4===(NH4)2SO4
本题解析:
本题难度:一般