1、选择题 下列事实中,不能用勒夏特列原理解释的是
[? ]
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
C.实验室常用排饱和食盐水的方法收集氯气
D.棕红色NO2加压后颜色先变深后变浅
参考答案:B
本题解析:
本题难度:一般
2、选择题 某温度下,反应N2(g)+3H2(g)?2NH3(g);△H<0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,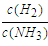 与原平衡相比变小了,则改变条件的可能有( )
与原平衡相比变小了,则改变条件的可能有( )
A.保持容器的容积不变,升高了温度
B.保持容器压强和温度不变,向容器内补充了Ar(g)
C.保持容器容积和温度不变,向容器内补充了N2
D.保持容器容积和温度不变,液化分离走部分NH3
参考答案:C
本题解析:
本题难度:简单
3、选择题 在一定条件下,发生CO+NO2?CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.降温后CO的浓度增大
D.降温后各物质的浓度不变
参考答案:B
本题解析:
本题难度:一般
4、简答题 工业上以氨气为原料制备硝酸的过程如图1所示:
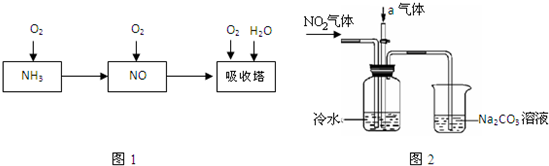
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护).
(1)工业上用氨气制取NO的化学方程式是______.
(2)连接好装置后,首先进行的操作是______.
(3)通入a气体的目的是______.
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是2NO2+Na2CO3═NaNO2+______+______
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O2.工业上可用N2O4与水反应来提高硝酸产率.N2O4与a气体在冷水中生成硝酸的化学方程式是______.
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g)?N2O4(g)的平衡常数K=______.若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为______.
参考答案:(1)氨气的催化氧化反应方程式为:4NH3+5O2催化剂.△4NO+6H2O,故答案为;4NH3+5O2催化剂.△4NO+6H2O;
(2)连接好装置后先要检验装置的气密性,当装置气密性良好才能进一步进行实验,故答案为:检验装置的气密性;
(3)二氧化氮通入水中会生成硝酸和一氧化氮,再通氧气可以使一氧化氮转化为二氧化氮从而提高了NO2的转化率,故答案为:提高NO2的转化率;
(4)根据元素守恒和得失电子守恒分析,2NO2和水反应生成硝酸,硝酸与碳酸钠反应生成硝酸钠和二氧化碳,其反应方程为:2NO2+Na2CO3═NaNO2+NaNO3+CO2,故答案为:NaNO3 、CO2;
(5)根据元素守恒和得失电子守恒分析,N2O4与水和氧气反应生成硝酸,反应方程式为:2N2O4+O2+2H2O=4HNO3,故答案为:2N2O4+O2+2H2O=4HNO3;
(6)根据平衡常数表达式计算,K=c(N2O4)c2(NO2)=12;
设反应的NO2为xmol/L
?2NO2(g)?N2O4(g)
起始浓度:2mol/L? 0
反应浓度:x? ?12x
平衡浓度:2-x? 12x
则? K=?12x(2-x)2=12? 所以x=1,NO2的最大转化率=12×100%=50%,故答案为:12;50%.
本题解析:
本题难度:一般
5、选择题 下列事实不能用勒夏特列原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.加催化剂,使氮气和氢气在一定条件下转化为氨气
C.可用浓氨水和氢氧化钠固体快速制氨
D.增大压强,有利于二氧化硫与氧气反应生成三氧化硫
参考答案:B
本题解析:
本题难度:简单