1、选择题 在一定条件下,向一固定容积的容器中投入2molNO2进行反应:2NO2?2NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是( )
A.2?mol?NO、0.75?mol?O2
B.1?mol?NO2、1.2?mol?NO
C.2?mol?NO
D.0.7?mol?O2
参考答案:该反应是可逆反应,可能反应中反应物不可能完全转化为生成物,但一定有部分反应物转化为生成物,
当二氧化氮不反应时,二氧化氮的物质的量是2mol,氧气和一氧化氮的物质的量是0,当二氧化氮完全转化为一氧化氮和氧气时,二氧化氮的物质的量为0,一氧化氮的物质的量是2mol,氧气的物质的量是1mol,实际上二氧化氮部分分解,则各物质的物质的量为:0<n(NO2)<2mol,0<n(O2)<1mol,0<n(NO)<2mol,
A.一氧化氮的物质的量应该小于2mol,故A错误;
B.根据氮原子守恒知,一氧化氮和二氧化氮的物质的量只和是2mol,故B错误;
C.该反应是可逆反应,二氧化氮不可能完全转化为一氧化氮,故C错误;
D.氧气的物质的量大于0而小于2mol,故D正确;
故选D.
本题解析:
本题难度:一般
2、填空题 物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度 b.氨水的电离程度
c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 (填“相同”或“不相同”),其原因是 。
参考答案:(1)SO32-+H2O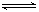 HSO3-+OH-(2分);(写一步即可得分)
HSO3-+OH-(2分);(写一步即可得分)
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);(2分)
(2) b,d(2分);a;(1分)c(1分)
(3)相同(1分) Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同(2分)
本题解析:(1)Na2SO3为弱酸强碱盐,SO32?水解显碱性,离子方程式为:SO32-+H2O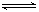 HSO3-+OH-;因为SO32?水解,使溶液显碱性,所以离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
HSO3-+OH-;因为SO32?水解,使溶液显碱性,所以离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
(2)室温下向10mL氨水溶液中加水稀释后,氨水浓度减小,a、溶液中离子浓度减小;但水解平衡向右移动,所以b、氨水的电离程度增大;c、水的离子积常数受温度影响,不变;d、因为c(H+)/增大,c(NH3·H2O)减小,所以c(H+)/ c(NH3·H2O)增大。
(3)NaClO2做氧化剂转化为Cl?,3molNaClO2得12mol e?,3mol NaClO2变质可分解为2mol NaClO3和1mol NaCl,2mol NaClO3做氧化剂转化为Cl?,得12mol e?,所以取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相等。
考点:本题考查盐类的水解、离子浓度比较、弱电解质的电离、氧化还原反应原理。
本题难度:困难
3、选择题 下列说法正确的是
A.0.5molO3,与11.2 LO2所含的分子数一定相等
B.25℃与60℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( Na0H)相等
D.2SO2(g)+O2(g) = 2SO3 (g)和4SO2(g)+wO2(g) = 4SO3 (g)的△H相等
参考答案:C
本题解析:A项:题目没有指明在标准状况下,11.2L的O2物质的量不一定为0.5mol,错误;B项:水的电离程度随着温度的升高而增大,25℃的PH大于60℃。错误;C项:等体积等物质的量浓度的盐酸和醋酸,虽然醋酸是弱电解质,但随着中和反应的进行,氢离子不断电离出来,最终氢离子的物质的量与盐酸的相同,正确;D项:⊿H与化学计量数成正比,错误。
考点定位:本题考查了化学里的基本概念。
本题难度:简单
4、选择题 NH4NO3受热分解产物为HNO3、N2、H2O,在此反应中发生氧化反应的氮原子与发生还原反应的氮原子的个数比是
A.3:5
B.5:4
C.5:8
D.5:3