1、选择题 已知短周期元素的离子aA2+、bB+ 、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子序数:d>c>b>a
B.原子半径:r (A)>r (B) >r (D)> r (C)
C.单质的还原性:A>B >D>C
D.离子半径:r (C3-)>r (D-)>r (B+)>r (A2+)?
参考答案:D
本题解析:aA2+、bB+ 、cC3-、dD-都具有相同的电子层结构,根据“阴上阳下”的原则,A、B在下一周期,C、D在上一周期;A带的正电荷比B多,说明A在B的右侧,C带的负电荷比D多,说明C在D的左侧。A、根据以上分析,原子序数:a>b>d>c,错误;B、B、A同周期,A在B的右侧;C、D同周期C在D的左侧。原子半径r (B) >r (A) > r (C) >r (D),错误;C、根据元素周期律判断单质的还原性:B>A >C>D,错误;D、aA2+、bB+ 、cC3-、dD-都具有相同的电子层结构,离子半径的大小取决于核电荷数,核电荷数越多,离子半径越小,r (C3-)>r (D-)>r (B+)>r (A2+),正确,答案选D。
本题难度:一般
2、选择题 下列物质的性质比较,正确的是 (?)
A.气态氢化物稳定性:HF>H2S>HCl
B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl
D.氧化性:F2>Cl2>Br2>I2
参考答案:D
本题解析:非金属性越强,氢化物的稳定性越强,A不正确,气态氢化物稳定性应该是HF>HCl>H2S;金属性越强最高价氧化物的水化物的碱性越强,则B不正确,碱性应该是RbOH>KOH> NaOH;C不正确,同周期自左向右非金属性是逐渐减弱的,即Cl>S>P;卤素单质自上而下氧化性逐渐减弱,D正确,答案选D。
点评:该题是高考中的常见考点,属于中等难度试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用元素周期律知识解决实际问题的能力。该题的关键是明元素周期律的含义,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 有人建议将氢元素排在元素周期表的第ⅦA族。下列事实能支持这一观点的是( )
①氢原子得到一个电子后最外层电子达到稳定结构?②氢分子的结构式为H—H
③与碱金属元素形成离子化合物M+[∶H]- ?④分子中原子间的化学键都属于非极性键
A.①②③
B.①③④
C.②③④
D.①②③④
参考答案:A
本题解析:ⅦA族元素原子在反应中易获得一个电子,在化合物中元素的化合价为-1价,易形成离子化合物。①H原子得到一个电子实现最外电子层稳定结构,在化合物中元素的化合价为-1价,符合ⅦA族元素的化合价,正确;②氢分子的结构式为H-H,符合ⅦA族元素各提供1个电子形成一对共用电子对,正确;③与碱金属元素形成离子化合物M+[:H]-,符合ⅦA族元素与碱金属形成离子化合物的特点,正确;④不只ⅦA族元素分子中原子间的化学键都属于非极性键,不支持氢元素排在元素周期表的ⅦA族的观点,错误。
本题难度:一般
4、填空题 甲、乙、丙、丁、戊五种短周期元素原子序数依次递增。甲最外层电子数是次外层的两倍,丙的次外层电子数比最外层少4个,丁形成的简单阳离子是同周期元素简单离子中半径最小的,戊是同周期主族元素中原子半径最小的。试用化学式回答下列问题:
(1)乙和戊形成的化合物中各原子最外层均满足8e-结构,其化学式为?;
(2)写出乙的最高价氧化物的水化物的浓溶液与甲单质反应的化学方程式?;
(3)戊的最高价氧化物与丁的最高价氧化物的水化物反应的离子反应方程式为?;
(4)常温下戊单质被NaOH溶液吸收的化学方程式为?;
(5)氢与丙形成原子个数比为1:1的液体,该物质中存在的作用力有(?)
①极性键?②非极性键?③离子键?④氢键?⑤范德华力
参考答案:(1)NCl3(2)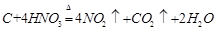
(3)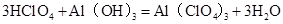 (4)
(4)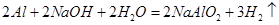 (5)①②④⑤
(5)①②④⑤
本题解析:甲最外层电子数是次外层的两倍,说明甲元素为C;丙的次外层电子数比最外层少4个,说明丙为O;甲、乙、丙三种短周期元素原子序数依次递增,所以乙为N;丁形成的简单阳离子是同周期元素简单离子中半径最小的,则为Al;戊是同周期主族元素中原子半径最小的,为Cl。
乙和戊形成的化合物中各原子最外层均满足8e-结构,则其化合价和最外层电子数代数和为8的绝对值,NCl3
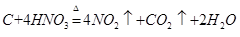
注意此题重点考查离子反应方程式的书写。戊的最高价氧化物Cl2O7与丁的最高价氧化物的水化物Al(OH)3的反应;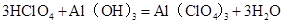 ,然后拆分成为离子反应式即可。
,然后拆分成为离子反应式即可。
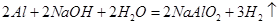
氢与丙形成原子个数比为1:1的液体,该液体为H2O2,双氧水中含有H-O极性键、O-O非极性键、氢键和范德华力,故选择①②④⑤。
本题难度:一般
5、选择题 两种微粒含有相同的质子数和电子数,这两种微粒的关系可能是:(1)同一元素的不同原子,(2)不同元素的原子,(3)两种不同的分子,(4)一种原子和一种分子,(5)一种原子和一种离子,(6)一种分子和一种离子,(7)两种不同的阳离子,(8)两种不同的阴离子,(9)一种阴离子和一种阳离子,其中正确的是
A.(1)(3)(4)(7)(8)
B.(1)(2)(5)(7)(9)
C.(1)(2)(5)(7)(9)
D.(1)(2)(3)(4)(5)
参考答案:A
本题解析:两种微粒含有相同的质子数和电子数,有以下几种情况:①若为原子,因为质子数相同,则一定是同种元素的不同原子;②若质子数与电子数相同,则为分子或原子;③若质子数与电子数不同,则都是阳离子或都是阴离子,所以(2) (5) (6) (9)是不可能存在的答案选A。
本题难度:一般