1、选择题 下列离子方程式正确的是
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.惰性电极电解氯化钠溶液:2Cl- +2 H2O  Cl2 ↑+H2 ↑+2OH—
Cl2 ↑+H2 ↑+2OH—
C.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+CO32- +2H2O
D.向Fe(OH)3悬浊液中加入醋酸:Fe(OH)3+3H+=Fe3++3H2O
参考答案:B
本题解析:A项中没有配平,正确应该是2Fe3++Cu=2Fe2++Cu2+。C项中没有配平,正确应该是Ca2++2HCO3-+2OH-=CaCO3↓+CO32- +2H2O
D项中醋酸为弱电解质,应写成化学式。
点评:本题属于基础题,只要掌握离子方程式的书写规格就可以解答,离子方程式是高考的常考知识点,考生在备考时应注意正确书写。
本题难度:简单
2、简答题 (16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和 生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:?。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是?。
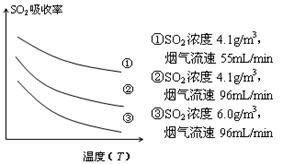
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则:?,
有利于提高SO2的吸收效率。
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
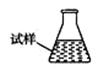
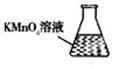
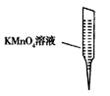
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_?(填字母)。
 ?
?

 ?
?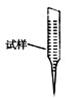
A? B? C? D? E
④ 滴定结果如下表所示:
滴定次数
| 待测溶液
的体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 2.20
| 20.20
|
则该药品中Na2SO3的质量分数为_________。
参考答案:(16分)
(1)SO2+H2O H2SO3;2H2SO3+O2=2H2SO4?(2分)
H2SO3;2H2SO3+O2=2H2SO4?(2分)
(或2SO2+O2  2SO3;SO3+H2O=H2SO4?或2SO2+O2+2H2O=2H2SO4)
2SO3;SO3+H2O=H2SO4?或2SO2+O2+2H2O=2H2SO4)
(2)① 1.6?(2分)
② 2NaHSO3+O2=Na2SO4+H2SO4?(2分)
③ 降低含硫烟气的温度(或减小含硫烟气的流速)?(2分)
(3)① 2MnO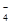 +5SO
+5SO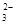 +6H+=2Mn2++5SO
+6H+=2Mn2++5SO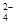 +3H2O ?(2分)
+3H2O ?(2分)
② 偏大 ?(2分)? ③ AC?(2分,漏选得1分,错选0分)
④ 63.00% 或63.0%?(2分,写“63%”得1分)
本题解析:(1)二氧化硫溶于水生成亚硫酸,亚硫酸与空气中的氧气反应生成硫酸,该过程的化学方程式为SO2+H2O H2SO3;2H2SO3+O2=2H2SO4?
H2SO3;2H2SO3+O2=2H2SO4?
(2)①根据电荷守恒,可得c(H+)+ c(Na+)= c(OH-)+2 c(SO32–)+c(HSO3–),所以c(HSO3–)= c(H+)+ c(Na+)- c(OH-)-2 c(SO32–)=(1.0+10-6-10-8-2×0.2)mol·L-1,所以c(HSO3–)近似为1.6mol/L;
②由①可知NaHSO3的溶液呈酸性,与氧气反应后生成的2种物质应是硫酸钠与硫酸,化学方程式为2NaHSO3+O2=Na2SO4+H2SO4;
③由图可知,二氧化硫的吸收率随温度升高而降低,①曲线的二氧化硫的吸收率最高,烟气的流速最小,所以提高SO2的吸收效率可以降低含硫烟气的温度(或减小含硫烟气的流速);
(3)①高锰酸钾溶液与亚硫酸钠发生氧化还原反应生成硫酸钠、硫酸锰、水,所以步骤iii所发生反应的离子方程式2MnO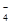 +5SO
+5SO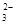 +6H+=2Mn2++5SO
+6H+=2Mn2++5SO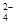 +3H2O;
+3H2O;
②配制高锰酸钾溶液时仰视定容,则所配溶液的浓度偏低,滴定时消耗高锰酸钾溶液的体积就偏大,造成最终测得药品中Na2SO3的含量偏大;
③根据实验步骤可知,样品溶液放在锥形瓶中,滴定溶液放在滴定管内,高锰酸钾具有强氧化性,所以应使用酸式滴定管,因此最合理的组合是AC;
④由表中数据可知3次使用高锰酸钾溶液的体积分别是20.01mL、19.99mL、18.00mL,第三组数据与前两组差距较大,舍去,用前两组的平均值计算,平均值是20.00mL。根据2MnO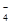 ~5SO
~5SO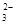 ,得样品中亚硫酸钠的质量为0.02L×0.01000 mol·L-1×2.5×10×126g/mol=0.63g,所以样品中亚硫酸钠的质量分数是0.63g/1.0000g×100%=63.00%。
,得样品中亚硫酸钠的质量为0.02L×0.01000 mol·L-1×2.5×10×126g/mol=0.63g,所以样品中亚硫酸钠的质量分数是0.63g/1.0000g×100%=63.00%。
本题难度:一般
3、选择题 下列离子方程式书写正确的是( )
A.用氢氧化钠溶液出去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
Mn2++Cl2↑+2H2O
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2Fe+3Cl-+H2O+4H+
D.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
参考答案:A.用氢氧化钠溶液出去铝表面的氧化膜的离子反应为Al2O3+2OH-═2AlO2-+H2O,故A正确;
B.用浓盐酸与MnO2反应制取少量氯气的离子反应为MnO2+4H++2Cl-?△?.?Mn2++Cl2↑+2H2O,故B错误;
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O,故C错误;
D.氢氧化铁溶于氢碘酸中的离子反应为2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 下列各反应的离子方程式书写正确的是
A.金属钠投入水中:Na + 2H2O = Na+ + OH-+ H2↑
B.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ + Fe2+
C.向Na2CO3溶液中加入过量CH3COOH溶液: CO32-+ 2H+= CO2↑ + H2O
D.过量CO2通入Ca(ClO)2溶液中: ClO-+ CO2 + H2O = HCO3-+ HClO
参考答案:D
本题解析:正确的答案选D。A、B中电子的得失不守恒,不正确;A.正确的是:2Na + 2H2O ="2" Na+ +2 OH-+ H2↑;B.正确的是:Cu +2 Fe3+= Cu2+ + 2Fe2+;醋酸是弱酸,应该用化学式表示,C不正确,C.正确的是: CO32-+2CH3COOH= CO2↑ + H2O+2CH3COO―
本题难度:一般
5、选择题 将足量的CO2不断通入KOH、Ba(OH)2、K[Al(OH)]4的混合溶液中,生成沉淀与通入CO2的体积的关系可表示为
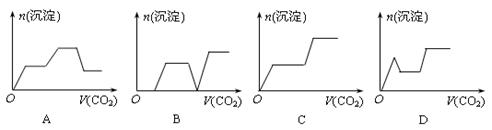
参考答案:A
本题解析:足量的CO2不断通入KOH、Ba(OH)2、K[Al(OH)]4的混合溶液中先后发生的反应:CO2+Ba(OH)2=BaCO3↓+H2O. CO2+2KOH=K2CO3+H2O. KAlO2+CO2+2H2O=KHCO3+Al(OH)3↓;K2CO3+H2O+CO2=2KHCO3;BaCO3↓+H2O+CO2=Ba(HCO3)2.所以生成沉淀与通入CO2的体积的关系可用A表示。?2与KOH、Ba(OH)2、K[Al(OH)]4的混合溶液反应的情况。
本题难度:一般