1、选择题 在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混和液中K+的物质的浓度为( )
A.0.2mol/L
B.0.25mol/L
C.0.45mol/L
D.0.225mol/L
参考答案:Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,此时溶液中溶质为硫酸钾、偏铝酸钾,根据硫酸根守恒,此时溶液中c(SO42-)=12×0.2mol/L=0.1mol/L,由离子方程式Al3++4OH-=AlO2-+2H2O可知,此时溶液中c(AlO2-)=14×0.2mol/L×12=0.025mol/L,由电荷守恒可知此时溶液中c(K+)=c(AlO2-)+2c(SO42-)=0.025mol/L+2×0.1mol/L=0.225mol/L,所以原混合溶液中为反应后溶液中c(K+)为0.225mol/L×2=0.45mol/L.
故选:C.
本题解析:
本题难度:一般
2、选择题 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸的物质的量浓度为9.2 mol/L
B.若该硫酸与等体积的水混合,所得溶液的质量分数小于49%
C.若实验室需要4.6 mol/L的稀硫酸480 mL,则应用量筒量取该硫酸125.0mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol/L
参考答案:C
本题解析:根据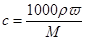 可知,硫酸的浓度是
可知,硫酸的浓度是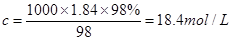 ,A不正确;由于硫酸的密度随浓度的增大而增大,所以若该硫酸与等体积的水混合,所得溶液的质量分数大于49%,B不正确;由于容量瓶的规格没有480ml的,因此应该选择500ml容量瓶,则需要浓硫酸的体积是
,A不正确;由于硫酸的密度随浓度的增大而增大,所以若该硫酸与等体积的水混合,所得溶液的质量分数大于49%,B不正确;由于容量瓶的规格没有480ml的,因此应该选择500ml容量瓶,则需要浓硫酸的体积是 ,选项C正确;等质量的水与该硫酸混合所得溶液的质量分数是49%,由于硫酸的密度随浓度的增大而增大,所以根据
,选项C正确;等质量的水与该硫酸混合所得溶液的质量分数是49%,由于硫酸的密度随浓度的增大而增大,所以根据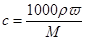 可知,所得溶液的物质的量浓度小于9.2 mol/L,答案选C。
可知,所得溶液的物质的量浓度小于9.2 mol/L,答案选C。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数的数值,下列说法中正确的是
A.1.5mol石墨含有C-C键数为4.5NA
B.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3 NA
C.常温常压下,22.4L的NO2和CO2合气体含有2 NA 个O 原子
D.标准状况下,44.8L氟化氢中含有氟原子的数目为2NA
参考答案:B
本题解析:A:石墨晶体中每个C原子占有3/2个C—C键;B:混合气体中N与O个数比为1:2,即46g混合气体必然含有的原子数为3 NA;C:常温常压下,22.4L气体的物质的量无法计算,故无法确定所含原子个数;D:标准状况下HF是非气态;选B
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数的值,下列表述不正确的是(?)
A.标准状况下,22.4L氢气所含原子数是2NA
B.5.4g水所含的分子数为0.3NA
C.含1mol硫酸钾的溶液中硫酸根离子数为2NA
D.1mol金属钠与水反应失去的电子数为NA
参考答案:C
本题解析: C、含1mol硫酸钾的溶液中硫酸根离子数为NA,错误。
本题难度:一般
5、选择题 相同质量的镁和铝所含原子数目比是(? )
A.1∶1
B.24∶27
C.9∶8
D.2∶3
参考答案:C
本题解析:n(Mg)∶n(Al)= =9∶8。
=9∶8。
本题难度:简单