| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《电解池原理》试题特训(2019年最新版)(十)
参考答案:C 本题解析:析出铜的物质的量是1.92g÷64g/mol=0.03mol,转移电子的物质的量是0.03mol×2=0.06mol,则关键电子守恒可知,析出银的物质的量是0.06mol,质量是0.06mol×108g/mol=6.48g,答案选C。 本题难度:简单 3、选择题 用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复原浓度、原体积,应加入的适当物质是 参考答案:CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子的放电能力大于SO42-?离子的放电能力,所以OH-离子放电生成氧气; 本题解析: 本题难度:简单 4、选择题 下列解释事实的方程式不正确的是 |
参考答案:B
本题解析:A、向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++ 3NH3·H2O===Al(OH)3+ 3NH4+,正确;B、加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁是利用氢氧化镁与氯化铁水解生成的氢离子反应,使氯化铁的水解平衡正向移动,铁离子转化为氢氧化铁沉淀而除去,错误;C、常温下0.1mol/L 氯化铵溶液pH=5是因为铵离子水解呈酸性:NH4+ +H2O 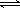 NH3·H2O+ H+,正确;D、电解精炼铜时阳极铜溶解:Cu — 2e— ="==" Cu2+,正确。
NH3·H2O+ H+,正确;D、电解精炼铜时阳极铜溶解:Cu — 2e— ="==" Cu2+,正确。
考点:考查离子方程式正误判断。
本题难度:一般
5、填空题 (20分)电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为?。
在X极附近观察到的实验现象是?。
② Y电极上的电极反应式为?。
③总反应方程式:?;
⑵若要在铁制品上镀一定厚度的银层
① X电极材料是?(填铁或银);
② a是?溶液
③ Y电极反应方程式:?;
⑶若X、Y都是铂电极,电解某金属的氯化物(XCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2 g .
①该金属的相对原子质量是?;②电路中有??mol电子通过。
参考答案:(20分)(1)(每空2分)① 2H++ 2e- =H2↑;溶液变红?
② 2Cl— -2e-=Cl2↑
③ 2NaCl+2H2O  ?2NaOH+H2↑+Cl2↑
?2NaOH+H2↑+Cl2↑
(2)(每空2分)① Fe?② AgNO3?③Ag-e-=Ag+
(3)(每空3分)① 64?② 0.1
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质结构和.. | |